1、处方前研究
(1)原料药的理化性质
(2) 离子相容性
(3) 储存条件的影响
(4)pH 调节剂的影响
(5) 气体的影响
(6)等张(等渗)调节剂的影响
2、
处方筛选研究
(1) 处方组成
(2) 制备过程
(3) 各批次产品的稳定性数据
(4)上市产品的稳定性数据
(5) 注射剂的重点考察项目
(6) 有效期和储存条件建议
3、
制备工艺的优化
(1) 加料顺序
(2) 灭菌方法的选择
(3) 光稳定性研究
(4) 温度偏离研究
4、容器相容性评价
(1) 管道相容性:管道浸入大量药液、
药液滞留管道内
(2)滤器相容性:化学相容性评价
(3)容器相容性:溶液在316L不锈钢容器内的保持时间实验
5、原料药的理化性质
吸湿性、静电性、溶解性、流动性、稳定性(杂质控制)、残留溶剂
6、离子相容性研究
研究可能的离子与成品制剂的相容性。将适宜的离子或化合物加入制剂溶液中, 40℃下加速实验,以监测溶液外观变化,变化的结果按时间进行记录。保证实验条件始终得到有效控制。
表1 离子及其来源
|
析出性离子
|
可能的来源
|
加入的化学品
|
|
钠
|
玻璃瓶
|
氢氧化钠
|
|
钾
|
玻璃瓶
|
氢氧化钾
|
|
钙
|
玻璃瓶
|
氢氧化钙
|
|
镁
|
橡胶塞
|
氧化镁
|
|
铝
|
橡胶塞
|
氧化铝
|
|
锌
|
橡胶塞
|
硫酸锌
|
|
亚硫酸盐
|
橡胶塞
|
偏亚硫酸氢钠
|
|
硫酸盐
|
橡胶塞
|
硫酸
|
|
氯
|
橡胶塞
|
盐酸
|
|
铵
|
橡胶塞
|
氨水
|
|
铁
|
橡胶塞
|
铁屑
|
|
碳
|
橡胶塞
|
药用活性炭
|
|
硅
|
玻璃瓶
|
二氧化硅胶体
|
表
2
离子相容性实验结果
|
加入试剂
|
最初的外观
|
放置7天的外观
|
|
无处理的溶液
|
透明红色溶液
|
透明深红色溶液
|
|
钠
|
紫色溶液
|
紫色溶液
|
|
钾
|
紫色溶液
|
紫色溶液
|
|
钙
|
紫色溶液
|
紫色溶液
|
|
镁
|
带沉淀的红黑色溶液
|
有沉淀的红黑色溶液
|
|
铝
|
暗红色溶液
|
暗红色溶液
|
|
锌
|
带沉淀的红色凝胶
|
带沉淀的红色凝胶
|
|
亚硫酸盐
|
透明红色溶液
|
透明红色溶液
|
|
硫酸盐
|
带沉淀的凝胶
|
药物从水中析出
|
|
氯
|
透明红色溶液
|
药物从水中分离
|
|
铵
|
紫色溶液
|
紫色溶液
|
|
铁
|
红黑色溶液
|
红黑色溶液
|
|
碳
|
红黑色溶液
|
红黑色溶液
|
|
硅
|
透明红色溶液
|
透明红色溶液
|
实验数据表明,对碱和碱性离子不稳定,易变为红黑色或紫色。硫酸根离子和氯离子会导致药物从水中析出,而亚硫酸根离子无此反应。建议:不宜与碱性金属离子及其化合物接触。
6、溶解度的pH依赖性
作为处方前研究的一部分,考察了AQ溶解度与pH之间的关系。当pH值大于6时, AQ极易溶于水;pH值为8时,其溶解度大于250mg/mL;pH小于或等于6时,其溶解度大约为35 mg/mL。
7、水溶液中pH稳定性
考察pH值对AQ水溶液稳定性的影响:醋酸盐缓冲液(pH=3)醋酸盐缓冲液(pH=5)磷酸盐缓冲液(pH=7)碱式硼酸盐缓冲液(pH=9)碱式硼酸盐缓冲液(pH=11)
图1 25ºC条件下pH值对AQ溶液含量的影响
8、药物浓度与渗透压
作为等渗的静脉注射溶液,AQ制剂允许的渗透压范围在270 mOsm和330 mOsm之间。图2 显示水中AQ浓度对溶液渗透压的影响。虽然在水中极易溶解,但AQ产品的等渗要求限制了制剂中浓度不能超过50 mg/mL。
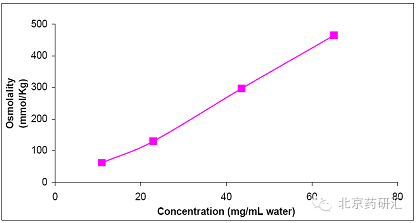
注:横坐标:浓度
(mg/mL
水中
)
;纵坐标:渗透压
(mmol/Kg)
。
9、吹氮气/或容器顶部充空气
溶液中和容器顶部存在的氧气,加速了杂质的产生。氮气和容器顶部充氮气的方法经常用于生产和储存过程中,保护制剂中氧敏感性的物质。将溶液分别置于通氮气和空气的环境下,灌入带塞的和封圈的小瓶中,观测其物理变化。将分装好的各样品置于加速实验条件下(40°C/75% RH, 60°C和 80°C),监测其外观颜色变化。
10、缓冲体系评价
AQ制剂中缓冲剂的作用,保持制剂所需的pH环境。下面列出了研究过的一些缓冲体系: 磷酸盐缓冲液: 磷酸氢二钠(Na2HPO3)/磷酸二氢钠((NaH2PO3); 醋酸盐缓冲液 :10mM和20mM ; 碳酸钠(Na2CO3)/碳酸氢钠(NaHCO3); 氨基丁三醇缓冲液 20mM:用氢氧化钠调pH
11、抗氧剂
水解产物被氧化以后会使AQ制剂变黄。通过测定溶液中溶解氧气的水平,评价不同化合物的抗氧能力,如抗坏血酸、谷胱甘肽、亚硫酸盐、MTG。本实验确定MTG作为AQ的首选抗氧剂,进行进一步评价。图3 体现了单硫代甘油浓度对溶液中溶解氧的水平的影响。单硫代甘油能有效地降低溶液中溶解的氧气,将硫代甘油的浓度升至0.25%,就检测不到溶液中溶解氧的水平(0ppm)。
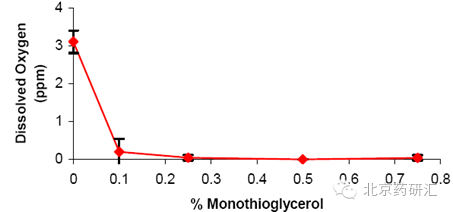
图
3
单硫代甘油浓度中溶解氧水平的影响
表
3 80
°
C
条件下单硫代甘油
(MTG)
对制剂稳定性的影响
|
|
外观
|
含量
(mg/mL)
|
有关物质
(%)
|
|
样品鉴定
a
|
MTG(%)
|
开始
|
5
天
|
开始
|
5
天
|
开始
|
5
天
|
|
11532
|
0.0
|
CL
|
暗黄色并伴有桔黄色沉淀
|
18.35
|
14.47
|
ND
|
0.175
|
|
11532-177B
|
0.01
|
CL
|
白浊、溶液顶部有黄色层、桔黄色沉淀
|
19.08
|
13.83
|
ND
|
0.183
|
|
11532
|
0.05
|
CL
|
白浊、溶液顶部有黄色层
|
21.16
|
16.29
|
ND
|

















