作者 l
放翁是水货
编辑
l
细胞房间
Keytruda在肺癌和黑色素瘤方面的治疗有长足进展
4月16日,美国,默沙东公司今日在ACCR年会上宣布其PD-1免疫疗法Keytruda(Pembrolizumab)在非小细胞肺癌(NSCLC)和黑色素瘤临床试验中都展示出卓越的疗效,可以进一步降低患者的死亡风险。
KEYNOTE-189
研究是一项关键3期临床试验
,评估了Keytruda联合培美曲塞和顺铂或卡铂一线治疗转移性非鳞状NSCLC的疗效。结果显示,与单独化疗相比,Keytruda联合化疗显著改善了总生存期(OS),将死亡风险降低一半。并且这一获益与患者PD-1表达水平无关,在PD-L1阴性的患者、PD-L1肿瘤比例评分为1-49%的患者以及TPS大于50%的患者的三个亚组中均能够观察到临床获益。此外
Keytruda
加培美曲塞加铂类化疗也取得了无进展生存期(PFS)的显著改善。
Keytruda辅助治疗黑色素瘤,可以降低患者43%的晚期复发风险。KEYNOTE-054研究是一项关键3期临床试验,评估了Keytruda作为辅助疗法用于术后高风险3期黑素瘤的疗效。结果显示,Keytruda显著延长了无复发生存期(RFS),与安慰剂相比疾病复发或死亡风险降低了43%。且无论患者无论BRAF突变状态如何,RFS的获益能够在各亚组的患者中观察到。此外,Keytruda的安全性与之前在黑素瘤患者中进行的试验结果一致。

双特异性抗体APVO436显示出潜在的抗肿瘤活性
4月16日,美国,Aptevo Therapeutics公司在今日的ACCR年会上公布其了双特异性抗体
APVO436
的预临床试验结果。
APVO436
是该公司ADAPTIR蛋白治疗平台上研发的同时靶向CD123和CD3的双特异性抗体药物,可以增强T细胞抗肿瘤活性。
临床前数据显示该药物对于表达CD123的肿瘤具有强有力的T细胞毒性,并能够抑制细胞因子释放。具体表现为
APVO436
能够以更低EC50值结合CD123和CD3阳性细胞;在比较原发性AML受试者样品和正常供体样品的实验中,能够观察到有效诱导内源性T细胞活化和增殖并伴有CD123表达细胞的耗竭,在小鼠骨髓瘤动物模型实验中,APVO436能够快速降低骨肿瘤负荷。

VBL Therapeutics
展示了抗肿瘤免疫新靶点相关研究
4月16日,美国,
VBL Therapeutics
公司在今日的ACCR年会上展示了最新的研究,证实其新研发的双特异性抗体可以通过与肿瘤膜受体MOSPD2结合诱导免疫细胞介导的癌细胞杀伤作用。抗肿瘤靶点的选择,特异性是重要的一环,因为其会直接影响药物的安全性。VBL Therapeutics的新数据表明,不同的实体肿瘤能够高表达的MOSPD 2蛋白,该蛋白与肿瘤细胞的侵袭和转移密切相关,而其新研发的双特异性抗体通过与T细胞蛋白CD3和肿瘤受体MOSPD 2结合,可以利用这种肿瘤特异性诱导肿瘤细胞的杀伤作用,数据显示其对部分实体肿瘤和髓系恶性肿瘤具有较强的活性。

Leap Therapeutics
公布了DKN-01研究新进展
4月16日,美国,Leap Therapeutics在今日的AACR年会上介绍了关于Leap抗DKK1单克隆抗体DKN-01的最新研究数据。预临床的数据显示DKN-01具有免疫调节活性,能够增强天然免疫,减少髓系来源抑制细胞(
MDSCs
),并增加MDSCs上的PD-L1表达,与PD-1抑制剂的联合使用具有协同抗肿瘤活性。
在DKN-01
的1期临床试验中,与Keytruda(P
embrolizumab
)联合使用,评估其治疗晚期食管癌的疗效。1期临床剂量递增试验的初步结果表明,患者对于联合用药耐受性良好,且DKN-01可以提高患者对于PD-1疗法的应答率。
Lenzilumab有望成为缓解CAR-T疗法不良反应的潜在药物
4月16日,美国,Humanigen公司今日宣布其与德克萨斯大学安德森癌症中心签署了一项协议,共同开展
Lenzilumab
相关研究,探索其在
CAR-T 疗法
辅助治疗方面的潜力。Lenzilumab是靶向可溶性粒细胞巨噬细胞集落刺激因子(GM-CSF)的重组单克隆抗体。前期的预临床数据显示,中和体内循环的GM-CSF有可能阻断或预防炎症级联反应,从而缓解CAR-T诱导的副作用---神经毒性和细胞因子释放综合征。

BeiGene
启动Tislelizumab治疗复发或难治性成熟T细胞和NK细胞淋巴瘤2期临床研究
4月16日,中国,BeiGene公司今日宣布在Tislelizumab的全球2期临床试验中已经有第一位淋巴瘤患者服药接受治疗。这项研究是评估这个PD-1抗体对于复发或难治性成熟T细胞和自然杀伤细胞淋巴瘤的有效性和安全性。Tislelizumab还在全球多个地区开展实体肿瘤的3期试验,包括非小细胞肺癌、肝细胞癌和食管鳞癌,以及在中国开展的复发/难治性经典霍奇金淋巴瘤和尿路上皮癌的两个关键的2期试验。
Glenmark Pharmaceuticals开启了GBR 830治疗中重度特应性皮炎2b期临床研究
4月16日,美国,Glenmark Pharmaceuticals公司今日宣布启动GBR 830的2b期临床试验,GBR830是一种治疗中重度特应性皮炎的新型抗体药物。该试验的主要终点是评估GBR 830与安慰剂相比的疗效,次要和探索性试验终点包括药物安全性和药效学的其他测试,预计2018年6月该研究将正式运行。
GBR 830是靶向OX40蛋白的特异性单克隆抗体。OX40是在活化T细胞和记忆T细胞上表达的共刺激免疫检查点受体,共刺激信号对T细胞活性至关重要,OX40和OX40L之间的结合是自身免疫疾病严重程度的生物标志物。该途径的激活导致激活的T细胞转化为记忆T细胞,并促进炎症的发生发展。据前期的研究显示GBR 830抑制活化T细胞和调节性T细胞中OX40和OX40L的结合,从而减少与特应性皮炎症状相关的炎症发生。
Sutro Biopharma的ADC新药具有潜在抗卵巢癌活性
4月16日,美国,Sutro Biopharma公司今日的美国癌症研究协会年会上公布了其ADC新药
STRO-002
的研究进展。STRO-002在临床前异种移植动物模型中显示出对卵巢癌极好的抗肿瘤活性。STRO-002是靶向叶酸受体α的抗体药物偶联物,在多种卵巢癌异种移植模型中显示出对卵巢癌细胞的细胞毒性,并显著抑制肿瘤生长。在非人灵长类动物中进行的安全性研究中,STRO-002在临床试验剂量下耐受性良好,未观察到与其它ADCs相关的常见的、潜在的不良反应。

FDA批准了BioAtla的新药研发申请
4月16日,美国,BioAtla公司今日宣布FDA已经批准了该公司的新药
BA3021
临床试验申请。这是一种条件性激活的靶向ROR2蛋白的抗体药物偶联物,可用于局部晚期或转移性实体瘤的治疗。公司计划近期开展该药的首次开放标记、多中心、剂量递增1期临床研究,旨在评估BA3021的药代动力学特性和安全性以及初步的抗肿瘤活性。
BMS的Nivolumab单抗在多项肿瘤临床治疗中获得积极进展,将进一步拓宽其临床适应症
4月16日,美国,BMS在AACR 2018大会上公布了CheckMate-227研究关键3期临床的初步结果。这项多中心的临床研究评估了
Nivolumab
联合低剂量Ipilimumab用于高肿瘤突变负荷(
TMB≥10个突变/Mb
)的晚期非小细胞肺癌患者一线治疗的临床获益和安全性。结果显示,在无进展生存期(
PFS
)方面联合治疗相较于化疗有显著获益,联合治疗组的一年无进展生存率是化疗组3倍以上(
联合治疗和化疗组分别为43%和13%
),联合治疗组总体缓解率(
45.3%
)和化疗组(
26.9%
)相比提高近2倍。在安全性比较方面,N
ivolumab
与低剂量Ipilimumab联合治疗组的3-4级治疗相关不良事件发生率为31%,化疗组为36%。
小编点评:
CheckMate-227研究的结果是首次证实了两种免疫肿瘤药物一线联合能够使高TMB的NSCLC患者获益,这一数据对于未来肺癌3期患者的优化治疗具有重要的参考价值。因为这些数据证明了在肺癌患者中可通过分子检测来明确潜在的生物标志物,并选用合适的治疗策略提高临床应答率,控制疾病进展。
继在2018 AACR年会上公布了其联合免疫疗法Opdivo加Yervoy在肺癌患者中的突破性数据后,同一时间该疗法获得了美国FDA的批准,成为首款用于初治的中高危晚期肾细胞癌患者的一线疗法。此次批准是基于一项3期临床试验CheckMate-214的结果,在该研究中中高危晚期RCC患者接受了4个周期的Opdivo+低剂量Yervoy联合疗法,结果显示联合疗法显示出相比当前标准疗法舒尼替尼显著改善的总生存期(OS)获益,将患者的死亡风险降低了37%。与标准疗法相比,Opdivo + Yervoy也提供了持久的临床疾病缓解率,以及更高的客观缓解率。
小编点评:
肾癌是所有泌尿系统癌症中最致命的一种,每年有众多患者的生命受到该肿瘤的威胁。今天FDA批准Opdivo + Yervoy用于晚期RCC有可能改变肾癌的一线治疗格局,同时对于患者而言,这不仅仅是一种新的治疗选择,它代表了患者的生命有望得到延长。
Nivolumab治疗复发性或转移性头颈部鳞状细胞癌显著提高总生存率。CheckMate-141研究是一项评估opvivo ( nivolamab )与化疗(
西妥昔单抗、多西紫杉醇或甲氨蝶呤
)在铂类治疗失败后复发或转移的头颈部鳞癌(
SCCHN
)患者中的疗效的3期开放标记随机试验。目前的2年总生存率(
OS
)数据显示,接受Opdivo治疗的患者在至少两年随访后死亡风险降低32%,中位OS为7.7个月,而标准化疗为5.1个月;Opdivo的两年生存率为16.9%,而标准化疗的两年生存率为6.0%。在安全性方面,两年随访中的安全状况与之前的研究分析一致。
4月18日,BMS又一次宣布FDA已经受理了该药治疗小细胞肺癌的补充生物许可申请并予以优先审评。这项适应症的申请是基于1/2期临床CheckMate-032研究,该项研究评估了
Opdivo
单药获联合Yervoy治疗晚期转移性实体瘤包括小细胞肺癌的有效性和安全性。试验数据显示Opdivo联合疗法可以提高晚期小细胞肺癌患者的客观应答率并延缓疾病进展。针对这一适应症的申请FDA将在今年8月予以最后批复。

复宏汉霖VEGF单抗3期临床即将拉开序幕
4月16日,中国,复新医药对外公告称该公司研发的单克隆抗体生物类似药HLX-04(重组抗VEGF人源化单克隆抗体注射液)1期试验已经完成对产品药代动力学特性和免疫原性的验证。HLX-04与原研药的药物动力学均达到了生物等效,与原研在免疫原性方面未观察到不同,公司计划于近期启动治疗转移性结直肠癌的临床3期试验,以进一步验证该药的有效性。
Celldex公司治疗三阴性乳腺癌的临床试验未达到主要临床终点而被迫中止
4月16日,美国,Celldex公司今日公布了其在研药物G
lembatumumab vedotin(
靶向跨膜糖蛋白非转移性黑素瘤蛋白B)治疗三阴性乳腺癌的临床试验最新结果。这是一项与卡培他滨头对头、随机、2b期临床研究,数据显示Glembatumumab vedotin治疗未能改善PFS(2.9月 VS 2.8月),同时在ORR和OS的次要终点方面两个治疗组也没有显著差异。
Alligator Bioscience
展示了免疫激活抗体ATOR-1015的预临床数据
4月17日,瑞士,Alligator Bioscience公司在今日的ACCR年会上展示了免疫激活抗体ATOR-1015的临床前数据。ATOR-1015是一种双特异性肿瘤导向抗体,能够靶向CTLA-4和OX40,并选择性激活免疫系统,而不增加系统性的药物毒性。临床前数据表明ATOR-1015能够实际定位于肿瘤区域并定向激活该区域的免疫系统应答,其可以与PD-1阻断抗体的联合使用,并表现出协同抗肿瘤活性。此外,ATOR-1015也显示出优于单靶向CTLA-4和OX40抗体的功效。

Praxbind获批用于紧急情况下的凝血治疗
4月17日,美国,BI公司今日宣布FDA今日对
Praxbind® (I
darucizumab
)
的临床使用给予了全面的批准。当患者在紧急手术或危及生命过程中出现无法控制的出血需要逆转Pradaxa的抗凝作用时,可以使用Praxbind® (I
darucizumab
)进行紧急止血治疗。

新型免疫检查点抑制剂BAY194254亮相ACCR大会
4月17日,以色列,Compugen公司今日宣布拜耳公司在ACCR大会上展示了
BAY 194254
在癌症免疫治疗中令人醒目的预临床数据。数据表明,BAY 1905254在各种小鼠模型中作为单一疗法显示出抗肿瘤活性,并且还显示出与其它癌症治疗方法组合的协同抗肿瘤效果。BAY 1905254是靶向ILDR2的治疗性候选药物,其中ILDR2是Compugen公司发现的一种新型免疫检查点,按照预定计划拜耳将在2018年将该项目推向人体试验。
喜康向CFDA递交了
贝伐单抗生物类似药
的临床试验申请并获得受理
4月17日,中国,喜康生物今日宣布CFDA 已经受理了贝伐单抗生物类似药的临床试验申请,并对其治疗治疗转移性结直肠癌、非小细胞肺癌、安多瓦里安癌以及宫颈癌、肾细胞癌和胶质母细胞瘤的方案进行审查。JHL1149是该公司在研的贝伐单抗的生物类似药,目前计划在中国的健康志愿者中进行1期药代动力学研究,然后在非小细胞肺癌患者中进行多国3期疗效研究,此前JHL1149的1期临床试验已经在欧洲正式开展。
喜康(武汉)生物医药有限公司(JHL Biotech)是一家生物制药初创企业,由一群在制药开发和运营方面拥有丰富经验的行业资深人士创建。喜康的使命是为世界提供高质量的低成本药品,喜康专注于研究和开发基于蛋白质的新疗法和生物仿制药。

罗氏的Hemlibra获FDA突破性疗法认定
4月17日,瑞士,罗氏公司今日宣布Hemlibra®(
Emicizumab-kxwh
) 再获 FDA 授予突破性疗法认定,用于治疗体内不含VIII因子抑制物的A型血友病患者。此次 Hemlibra再次获得突破性疗法认定,是基于3期临床HAVEN 3研究的结果。这项研究评估了该药物对于不含抑制物的A型血友病患者的临床疗效。结果显示与没有接受预防治疗的患者相比,每周或每两周接受一次Hemlibra预防治疗的患者可显著减少出血事件。
该药于2015年9月获得首个突破性疗法认定,用于体内已产生VIII因子抑制物的A型血友病成人和儿童患者的常规预防治疗,以防止或减少出血事件,并于2017获得 FDA 的上市批准。
安进偏头痛新药Aimovig(E
renumab
)达到3期临床的终点
4月17日,美国,Amgen公司今日宣布该公司的偏头痛新药Aimovig(E
renumab
)治疗发作性偏头痛(E
pisodic migraine
)的3b期临床达到主要终点。在这项LIBERTY多中心安慰剂对照的随机双盲临床研究中, 246名接受过2至4种其它预防疗法但是症状没有好转的发作性偏头痛患者随机接受了每月一次皮下注射的Erenumab或安慰剂治疗。试验数据显示接受Erenumab治疗的患者中30.3%的人偏头痛发作天数减少了至少50%,这一数值显著由于安慰剂组。同时,Erenumab治疗组患者的每月偏头痛天数、每月急性偏头痛药物使用量、每月偏头痛发作天数均有不同程度的减少。在安全性方面,97%接受Erenumab治疗的患者完成了LIBERTY临床试验的随机双盲部分,没有患者因为不良反应而停止治疗。
Erenumab是安进和诺华公司联合开发的是一种人源化的靶向CGRP受体的单克隆抗体,CGRP受体的激活与偏头痛发作相关,安进已经在多个大型临床试验和超过3000名患者中检验Erenumab在预防偏头痛方面的疗效和安全性。根据FDA的最后批复日期,该药物有望在几年5月通过审核并成功上市。
Mersana Therapeutics在ACCR大会上展示了其新的抗体药物偶联物及研发平台的相关研究
4月17日,美国,Mersana Therapeutics公司今日公布了其先进的ADC研发平台Dolaflexin和ADC药物XMT-1522的预临床数据。XMT-1522是一种靶向HER2阳性肿瘤的Dolaflexin型抗体药物偶联物,由其专有的HER2抗体与Auristatin通过柔性聚合物相偶联。一个分子的XMT-1522药物可以携带12分子毒性药物,这一设计在提高药物耐受性的同时也进一步提高抗肿瘤效力。目前该药正处在1期临床试验中,用以评估其在晚期乳腺癌和胃癌方面的抗肿瘤活性。
罗氏Tecentriq+Avastin组合疗法在肺癌治疗中取得突破进展
4月17日,美国,罗氏公司今日宣布Genentech公司的Tecentriq(Atezolizumab)在肺癌治疗的临床试验中缺德突破性进展。IMpower150研究是一项关键的3期临床研究,评估了Tecentriq与Avastin加紫杉醇和卡铂治疗晚期非鳞状非小细胞肺癌(NSCLC)的临床疗效和安全性。数据显示在联合免疫疗法使得所有亚组患者的PFS均得到显著改善(8.3 VS 6.8月)。同时在伴随有EGFR敏感突变、ALK基因重排和肝转移的患者,也可观察到具有临床意义的PFS优势,其中EGFR/ALK突变阳性亚组的PFS为9.7个月,EGFR外显子L858R缺失组的PFS为10.2个月,肝转移组的PFS为8.2个月。更重要的是在总生存期(OS)方面, Tecentriq与Avastin联合化疗可以延长晚期肺癌患者的生命。
该药目前已在美国获批治疗尿路上皮癌和NSCLC,Tecentriq+Avastin的治疗方案可能具有广谱的抗肿瘤效力,该疗法除了其确定的抗血管生成作用外,还可以通过抑制VEGF相关的免疫抑制促进T细胞肿瘤浸润,并激活T细胞免疫应答,从而进一步增强抗肿瘤效果。
CMP-001助力Keytruda打破黑色素瘤的免疫耐受状态
4月17日,美国,Checkmate Pharmaceuticals公司今日在AACR2018年会上发布了该公司开发的
CMP-001
与
Keytruda
构成的组合疗法治疗晚期黑色素瘤的临床1b期试验数据。试验结果表明,CMP-001和Pembrolizumab的组合治疗能够使接受过两种疗法且症状继续恶化的患者的肿瘤病灶持续减小,与这一疗效性对应的患者其他脏器的转移灶也相应减少。在69名接受治疗的黑色素瘤患者中,客观缓解率(
ORR
)达到22%,其中最长的疗效持续时间超过84周。
CMP-001是一种TLR9激动剂,对于单一PD-1抑制剂疗法产生抗性的黑色素瘤患者,联合免疫检查点抑制能够获得显著且持久的临床应答和临床缓解率。肿瘤细胞在发生发展过程中能够表达免疫检查点受体的配体来抑制T细胞激活,同时肿瘤组织周围能够形成免疫抑制的微环境进一步降低免疫系统的应答。CMP-001通过与TLR9受体结合,能够激活不成熟的DC细胞并大量生成干扰素同时增加其它共刺激因子的表达,并向T细胞呈递肿瘤抗原,诱导有效的抗肿瘤T细胞反应。
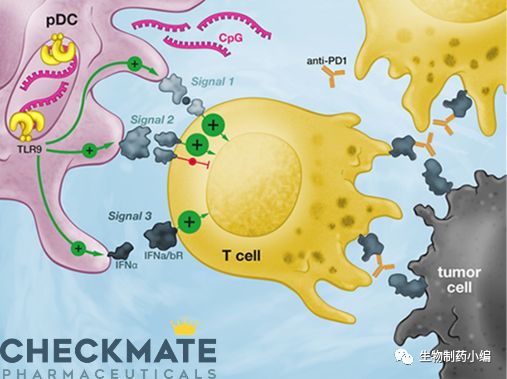
TLR9激动剂CMP -001通过检查点抑制剂激活pDC以驱动T细胞应答
Burosumab获批治疗X-连锁低磷性佝偻病
4月18日,美国,Kyowa Kirin和Ultragenyx公司今日宣布FDA批准了单克隆抗体药物Burosumab上市,用于治疗1岁及以上儿童和成年人的X-连锁低磷性佝偻病(XLH),同时该药也是全球第一个获批治疗XLH的药物。Burosumab是靶向成纤维细胞生长因子23(FGF23)的重组完全人源化单克隆IgG1抗体药物。FGF23通过调节磷酸盐排泄和肾脏内活性维生素D的生成来降低血清里面的磷酸盐和活性维生素D水平。XLH患者因FGF23过量导致磷酸盐的过度消耗,Burosumab通过与FGF23结合从而抑制其生物学活性。
XLH是一种罕见的遗传性低血磷酸佝偻病, XLH基因携带在X染色体上,虽然几乎所有的X连锁疾病都是隐性的,但是XLH是其中少数显性遗传的疾病。
Zymeworks
在ACCR大会上展示了其双特异性抗体药物偶联物及研发平台的相关研究
4月18日,加拿大,Zymeworks公司在今日的ACCR年会上介绍了其双特异性抗体药物偶联物的ZW49的预临床研究数据以及其优秀的ZymeLink ADC 药物研发平台。按预定计划,公司将在今年向FDA递交新药研发申请,用于开展HER2阳性肿瘤的治疗。
ZW49是一种拥有与ZW25相同的抗体框架的抗HER2双特异性抗体药物偶联物。前期的实验数据显示ZW49可能通过多种机制介导其抗肿瘤效果,包括HER2受体-抗体聚集增加和内化产生毒素介导的细胞毒性;增加细胞膜上HER2蛋白的结合和去除;以及某些效应器功能。

Xencor













