
作者:向日葵
转载请注明:解螺旋·临床医生科研成长平台
那是一个阳光明媚的上午,小编正要去参加PARTY,突然接到导师的电话说是试剂到了,可以开始做转染实验了……

导师的话怎么敢不听,可是小编是个放养的孩子,还没有做过转染实验呢。怎么办?只能去求助师兄师姐了,好在师兄看在我平时请他吃辣条的份上,给了我一本《葵花宝典之细胞转染》让我自学。

翻开本子,第一页介绍了细胞转染的类型。
转染(Transfection)是指将DNA或者RNA导入真核细胞中的过程。若DNA未与宿主细胞染色体整合,称为“瞬时转染”,若DNA与宿主细胞染色体整合并随后者的复制而复制,称为“稳定转染”。

转染的方法有很多,例如病毒转染、显微注射、脂质体转染、电穿孔法……
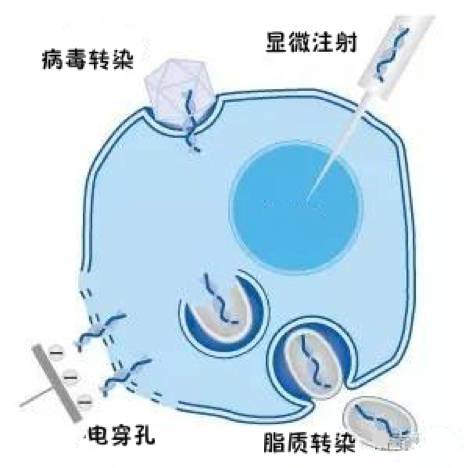
转染前,应根据实验目的、实验室现有的条件选择合适的细胞转染方法。
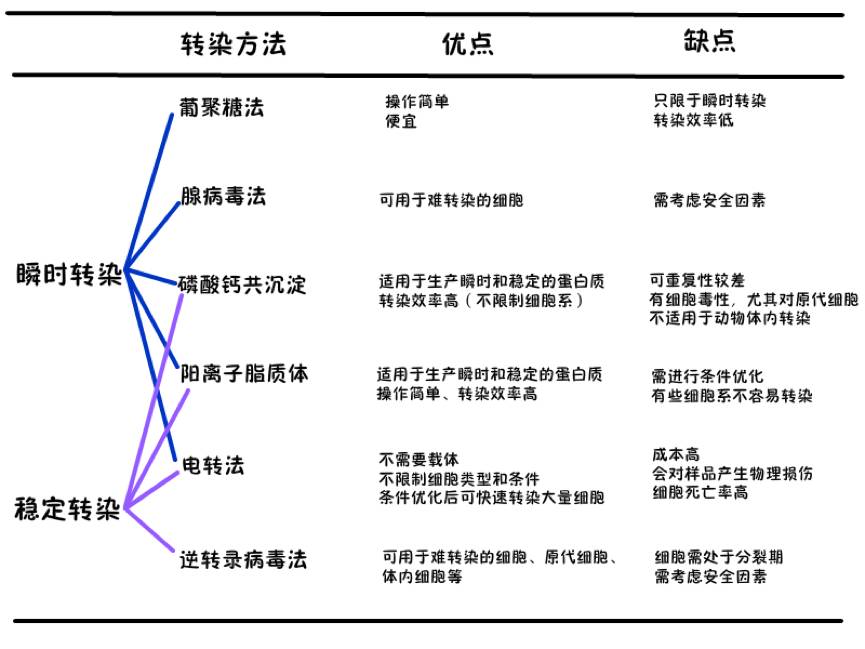
“原来除了导师让我做的脂质体转染之外,还有那么多转染方法啊。不管了,今天先主要学习一下脂质体转染方法再说。”
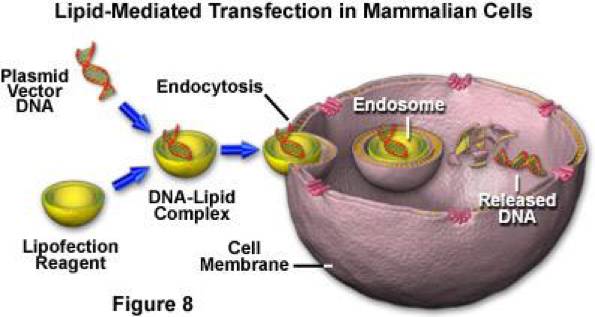
原理:转染试剂中的阳性离子与核酸中的阴性离子相结合后形成复合物。复合物通过细胞内吞作用将核酸转移至细胞中。
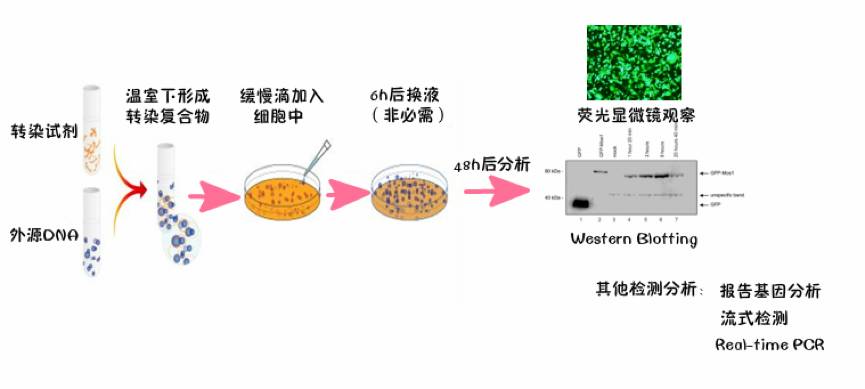
基本步骤:
细胞密度、细胞代数、DNA的质量、DNA与转染试剂的比例、血清质量都将影响细胞转染效率。
1、细胞质量
细胞代次:细胞在传代过程中会逐渐老化,不要用“骨灰级别”的细胞。选择低代次、处于对数生长期的细胞进行转染。

刚复苏的细胞:每个人都有起床气,细胞也有。刚复苏的细胞,应继续培养1~2代,让细胞完全“苏醒”后再进行转染。

细胞密度:转染时,细胞密度应根据转染试剂种类和实验目的来确定。一般来说,转染时的细胞密度应控制在50%~80%之间较好。
同时应注意在转染后48h,细胞收获时,细胞不要长得过“爆”。细胞接触抑制会严重影响细胞的状态(周期进程阻滞,凋亡增加等)从而影响实验结果。

交叉污染:如果同一个实验室同时培养两种以上的细胞,那就有可能发生这样的情节:A细胞不甘寂寞跑到B细胞家聊天然后就在那常住下了,从此以后A、B细胞傻傻分不清。

2、微生物
细胞污染的种类可分为细菌、真菌、病毒、支原体……所有污染都会产生错误的结果。在这些污染中,支原体污染较为普遍。
支原体污染几乎可以影响所有细胞的生长参数、代谢、染色体结构,其结果可导致非典型转染、转染效率偏低、研究数据不准确。在转染前可以使用环丙沙星提前处理一下细胞培养物。
如果发生污染最好还是扔掉细胞,重新转染。
3、核酸质量
在转染过程中,纯度不高的DNA(带有少量的盐离子、蛋白、代谢物等其他杂质或提取的DNA中残存内毒素)会严重影响转染效率。
除此之外,DNA分子构象也会影响转染的效率。其中超螺旋的质粒可达到较高的瞬时转染效率。
DNA含量应该控制在4~6ug,如果超过10ug,转染效率就会大大降低。

4、转染试剂
在转染前应优化质粒和脂质体的最佳配比。按照质粒:脂质体=
1:1,1:1.5,1:2,1:2.5,1:3,1:3.5的梯度比例来检测最佳转染比例(若质粒带有荧光,可通过观察每组荧光强弱来判断转染效率,若不带荧光可通过qPCR来检测各组转染效率)。
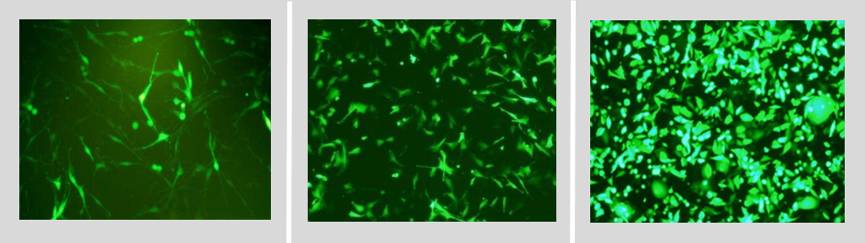
每种转染试剂都会提供一些已经成功转染的细胞株列表和文献,通过这些资料选择适合本细胞系的转染试剂。
5、血清
在转染前应先筛选出能促进本细胞系生长良好的血清批号。
为避免干扰到DNA-脂质体复合物的形成,在转染细胞时需用无血清无抗生素的培养基,以此来提高转染效率。
在转染后4~6小时内需更换培养基,一是为了去除具有毒性的脂质体,二是为了更换成有血清的培养基以提供更多营养物质给细胞。

如果想要在转染时加入血清,则需要设置实验对现有的条件进行优化,找到合适的转染试剂。
6、操作
细胞铺板
若在细胞铺板时操作不注意,则很可能会导致细胞分布不均。在接种平板时,可以先用培养基润湿整个板底,再加入细胞悬液。
转染时间
正在分裂的细胞往往要比处于静止状态的细胞更易于摄取并表达外源DNA。因此对大多数转染操作而言,细胞都应在转染当天或转染前一天进行接种。
试剂的配置
DNA与脂质体应充分混匀,混匀后静止10~15min。(混匀时应用无血清培养基或PBS来稀释。)
转染时
DNA-脂质体复合物应缓慢加入培养皿中并同时轻摇培养皿,以确保复合物的均匀分布,避免局部浓度过高。
换液
动作应尽量轻柔,此时细胞极为脆弱、贴壁性变差、很容易在外力的作用下悬浮起来进而导致细胞在换液过程中的损失。
换液前,应先将培养基预热。

“原来细胞转染也有这么多门道,我先试着做做看,等遇到解决不了的问题再去问师兄。”

投稿邮箱: [email protected]















