
2017年2月22日齐鲁制药易瑞沙(吉非替尼)仿制药伊瑞可获得上市许可,这意味着阿斯利康的重磅EGFR-TKI将在中国面临仿制药的冲击。伊瑞可目前已经被CFDA批准为非小细胞肺癌的一线用药,用于治疗携带EGFR突变的非小细胞肺癌患者。齐鲁制药将上市的伊瑞可是国内首个获批上市的易瑞沙仿制药,可有效提高患者用药的可及性,该药品原料药为我国首个“上市许可持有人制度试点品种”。
通用名:吉非替尼;Gefitinib;
商品名:易瑞沙;Iressa;
分子式:C
22
H
24
ClFN
4
O
3
分子量:446.9
CAS号:184475-35-2
结构式:

(1)日本
吉非替尼是英国阿斯利康公司研制开发的抗肿瘤靶向小分子药物。2002年8月,吉非替尼首先作为非小细胞肺癌一线治疗药物在日本上市,商品名为Iressa(易瑞沙)。
(2)美国
美国FDA于2003年5月5日根据Subpart H加速批准法规有条件批准了易瑞沙上市,用于二线单药治疗“既往接受基于铂剂的化学治疗和多西他赛化疗两种治疗均无效的局部晚期或转移性非小细胞肺癌”患者。此次NDA以Type 1 (New Molecular Entity)进行申请,申请号为021399。为评估试验内部一致性,FDA对某项研究结果进行了探索性亚组分析,结果显示全体受试者中的女性、亚洲人群、不吸烟或很少吸烟者几个亚组人群对易瑞沙显示出相对更优的客观肿瘤缓解率(女性:男性=25.0%:5.3%,亚洲人群:白种人=40.0%:11.5%,非吸烟者:吸烟者=38.1%:2.2%)。随后的大型临床研究结果验证了上述结论。另有数据显示亚洲人种EGFR突变率为30%~50%,高于欧美人种约10%,由此在IPASS研究中进行了生物标志物亚组分析,结果显示EGFR突变阳性受试者服用易瑞沙的PFS相对突变阴性者更长(HR为0.48,95%CI为0.36,0.64,P<0.0001)。上述结果使易瑞沙的研发公司阿斯利康将其市场定位于亚洲国家。这些研究结果导致FDA于2005年6月限制了易瑞沙在美国人群中的使用以及欧洲的撤市,而我国SFDA将易瑞沙在我国应用的适应症在原来的“既往接受过化学治疗的局部晚期或转移性非小细胞肺癌”基础上增加了“用于表皮生长因子酪氨酸激酶基因具有敏感突变的局部晚期或转移性NSCLC的一线治疗”。
2015年,由于Qiagen出品了新的检测试剂盒,能够检测出能从易瑞沙获益的潜在非小细胞肺癌患者,易瑞沙再次返回美国市场,作为非小细胞肺癌治疗的一线药物。2015年7月13日,FDA批准AstraZenca的IRESSA (250mg片剂)在美上市,其NDA申请号为206995,此次NDA以Type 5 (New Formulation or New Manufacturer)方式进行申请,其美国市场因NP (New Product)独占至2018.7.13,因ODE(孤儿药)独占至2022.7.13。
(3)欧盟
随着抗肿瘤靶向治疗经验的积累,以及对敏感人群的确定,吉非替尼对不同种族肺癌患者的EGFR突变显示出一定的活性,其疗效超过了常用的一线化疗手段,而对于没有突变的患者则效果甚微。因此,2009年7月1日,欧盟正式批准吉非替尼用于EGFR突变的成人局部晚期或转移性非小细胞肺癌患者的一线、二线和三线治疗用药,使分子靶向治疗在某些常见肿瘤治疗中的地位得到了巩固。
(4)中国
2005年,阿斯利康公司的吉非替尼进入我国市场,获得CFDA批准用于经过化疗的局部晚期或转移性非小细胞肺癌,但目前尚未批准作为晚期非小细胞肺癌的一线用药。而在靶向治疗的优势下,推动了易瑞沙的临床使用。2006年我国制定的《美国国立综合癌症网络(NCCN)非小细胞肺癌临床实践指南(中国版)》推荐吉非替尼作为晚期非小细胞肺癌的二线和三线标准治疗方案,吉非替尼成为国内抗肿瘤小分子靶向制剂的“领头羊”。
(1)全球销售情况
吉非替尼上市后,2002年即取得了0.67亿美元的业绩,然而受吉非替尼市场开发曲折的影响,以及抗肿瘤靶向小分子药物厄洛替尼的强势竞争,易瑞沙的市场在欧美一度受挫,表现起伏跌宕。2008年吉非替尼的销售额为2.65亿美元,但同比上一年增长了11.34%。2013年全球销售达到峰值6.47亿美元,随后呈逐年下降趋势。

(数据来源:AstraZeneca—Annual Report)
Datamonitor Healthcare预测,随着专利的到期,在仿制药冲击下易瑞沙全球销售将呈下降趋势。

(数据来源:Datamonitor Healthcare)
(2)国内市场情况
吉非替尼(易瑞沙)终端零售价原来为5,500 元/盒,2015年经过国家药品谈判后降至2,358 元/盒,且大部分用药费用由自费转向医保报销。2017年齐鲁制药上市伊瑞可将与易瑞沙瓜分原吉非替尼的市场份额,但总销售额仍将平稳增长。
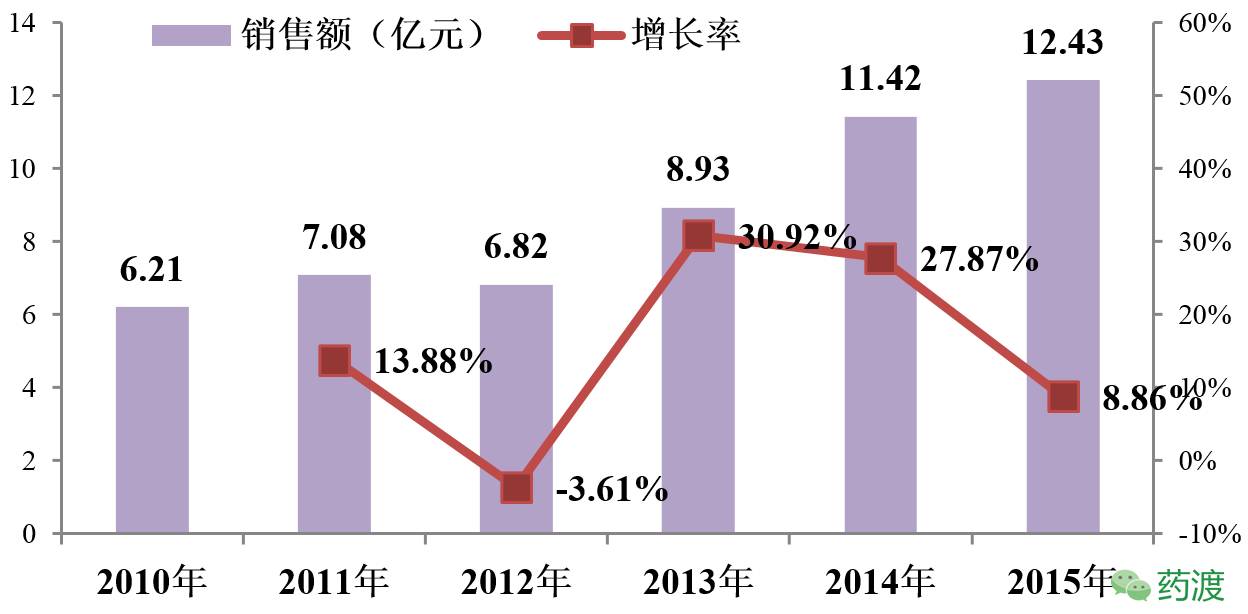
(数据来源:《抗肿瘤药物市场研究分析报告》)
(1)原研AZ核心专利

(数据来源:EPO)
小结:AZ公司在1996年申请专利保护了化合物,并在2003年对晶型及关键中间体的制备方法进行保护,完成了对吉非替尼核心专利的布局。
1. 化合物专利
,其权利要求9保护了吉非替尼化合物。该专利美国和中国同族已届满终止, EP (2019.3.1)仍处于保护期内。化合物专利同时还公开了两条制备吉非替尼的线路,但仅适宜实验室合成,不适用于工业化大生产。
2. 晶型专利
,保护了吉非替尼DMSO溶剂合物新晶型。中国和EP保护至2023.2.24届满,美国延长至2025.5.13。
3. 关键中间体的制备方法
,中国和EP保护至2023.9.9届满,美国延长至2025.12.29。该专利批露了一个关键中间体的制备方法,使得吉非替尼工业化大规模生产成为可能。
(2)齐鲁制药专利
2010年齐鲁制药就对吉非替尼进行立项研发,2011年申请了三个关于吉非替尼制备工艺的专利,以原研AZ的制备工艺为基础进行工艺改进,完成了工业化生产吉非替尼原料药的研发。2015年申请了乙二醇溶剂合物及其制备专利,突破了原研晶型专利的壁垒。齐鲁制药通过这种“仿中有创,仿创结合”的申请方式为进入吉非替尼仿制药市场提供了坚实的保障,在25家申报吉非替尼的国内药企中脱颖而出,通过了CFDA批准,取得了国内"首仿"上市资格,其专利布局功不可没。

(数据来源:SooPAT)
肺癌是中国发病率和死亡率排名第一的恶性肿瘤,每年中国新增肺癌患者73.3万人,其中80%为非小细胞肺癌,每年肺癌造成的死亡个人数为59.1万人。非小细胞肺癌由于其发病率高、患者基数大、分型复杂,是诸多抗癌药的必争市场。齐鲁制药伊瑞可(250mg/片,10片/盒)的销售价为2000元,而易瑞沙(250mg/片,10片/盒)在2015年经过国家药品谈判后也由5500元降至2358元(降幅达57%),仿制药的上市使得这一重磅药告别天价,使得更多肺癌患者受益。
齐鲁制药通过仿创结合的方式突破了原研晶型专利的壁垒,为进入吉非替尼仿制药市场提供了坚实的保障,在25家申报吉非替尼的国内药企中脱颖而出,取得了国内"首仿"上市资格,这种创新方式非常值得借鉴。















