阿斯利康宣布,其PD-L1抑制剂Imfinzi获得美国FDA批准,一线连用治疗广泛期小细胞肺癌成人患者
(1)公司:
阿斯利康(AstraZeneca)宣布,其PD-L1抑制剂Imfinzi(durvalumab)获得美国FDA批准,与依托泊苷加卡铂或顺铂联用,一线治疗广泛期小细胞肺癌(ES-SCLC)成人患者
(2)药物机理:
Imfinzi是一款人源化抗PD-L1单克隆抗体,它通过防止PD-L1与PD-1和CD80受体的结合,解除免疫抑制,增强人体免疫系统对抗癌症的能力
(3)入组标准与实验设计:
在名为CASPIAN的开放标签、随机、全球性3期临床试验中,广泛期SCLC患者接受了基于Imfinzi的组合疗法或者标准化疗组合的治疗。
(4)结果:
在Imfinzi组合疗法组中,患者死亡风险降低了27%(HR=0.73;
95% CI 0.59-0.91;
p=0.0047),中位OS为13.0个月,而化疗对照组为10.3个月。
结果还显示,Imfinzi组合疗法组患者确认的客观缓解率(68%)与对照组(58%)相比有所增加。
再生元公布了该公司开发的evinacumab,在治疗纯合子家族性高胆固醇血症患者的3期临床试验详细结果
(1)公司:
再生元(Regeneron)公司公布了该公司开发的evinacumab,在治疗纯合子家族性高胆固醇血症(HoFH)患者的3期临床试验详细结果
(2)药物机理:
Evinacumab是一种针对ANGPTL3的单克隆抗体。
ANGPTL3是脂蛋白脂肪酶和内皮脂肪酶抑制剂,在脂蛋白新陈代谢中具有重要作用
(3)入组标准与实验设计:
在名为ELIPSE的3期临床试验中,HoFH患者在接受其它降脂疗法之外,接受evinacumab或安慰剂的治疗。
这些患者中95%使用了他汀类药物,79%使用了PCSK9抑制剂。
(4)结果:
在接受治疗24周之后,evinacumab治疗组LDL-C与对照组相比,降低49%(p<0.0001)。
47%的患者LDL-C水平降至100 mg/dL以下,而对照组的这一数值为23%。
Evinacumab的工作原理
数据来源:regeneron
Akero Therapeutics宣布AKR-001在治疗NASH患者的2a期临床试验BALANCED中,达到第12周的疗效终点
(1)公司:
BMS和bluebird bio联合宣布,已递交CAR-T疗法bb2121的BLA,用于治疗复发/难治性多发性骨髓瘤(R/R MM)患者,这是首款递交上市申请的靶向BCMA的CAR-T疗法。
(2)药物机理:
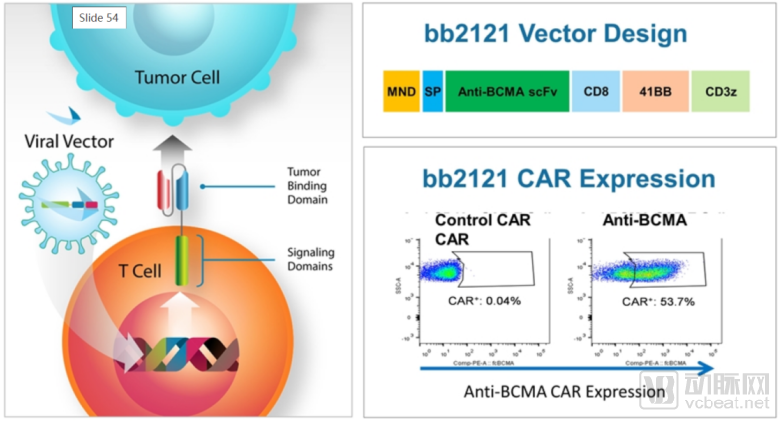
B细胞成熟抗原(BCMA)是一种在多发性骨髓瘤的癌细胞上普遍表达的蛋白质,它是这种侵袭性血液癌症的重要潜在靶点。
ide-cel可以识别并与多发性骨髓瘤细胞表面的BCMA结合
(3)入组标准与实验设计:
在名为KarMMa的关键性单臂、开放标签2期临床试验中,R/R MM患者都已经至少接受过免疫调节药物(IMiD)、蛋白酶体抑制剂(PI)、和抗CD38抗体的治疗,并且对疗法产生耐药性。
其中94%的患者对抗CD38抗体疗法产生耐药性,84%的患者具有三重耐药性。
(4)结果:
在总计128名能够评估疗效的患者中,患者的客观缓解率(ORR)达到73.4%,完全缓解率(CR)达到31.3%。
在中位随访时间为11.3个月时,这些患者的无进展生存期(PFS)达到8.6个月。
BMS和bluebird bio联合宣布,已经向FDA递交行业内首款靶向BCMA的CAR-T疗法的BLA
(1)公司:
第一三共和阿斯利康公司宣布,ADC-DS8201在治疗先前接受过治疗的HER2过度表达癌症患者的1期临床试验中,将55.6%的非小细胞肺癌(NSCLC)患者的肿瘤缩小
(2)药物机理:
Enhertu利用了第一三共特有的ADC技术,将人源HER2抗体曲妥珠单抗通
过四肽接头与一种新型拓扑异构酶1抑制剂链接,靶向癌细胞,并将药物递送至细胞内部
(
3
)0入组标准与实验设计:
共有60名经治HER2过度表达或突变的癌症患者参与该项1期临床研究,其中包括18名NSCLC患者、20名CRC患者,和其他几名不同肿瘤类型的患者。
(4)结果:
NSCLC患者的客观缓解率最高,其中55.6%的患者肿瘤被缩小,中位缓解时间达到10.7个月。
在携带HER2突变的NSCLC患者中的疗效更为明显,Enhertu的治疗使该组中72.7%的患者得到缓解
BB2121的原理
数据来源:bluebird
FDA批准由法国公司开发的Sevenfact上市,用于治疗和控制成人A型或B型血友病患者的出血事件
(1)公司
:
美
国FDA批准由法国公司LFB Biotechnology开发的Sevenfact上市,用于治疗和控制成人及12岁以上青少年A型或B型血友病患者的出血事件
(2)药物机理:
Sevenfact的活性成分是人类凝血因子VII的重组类似物,在基因工程改造的兔子的乳腺中表达,并分泌到兔的乳汁中。
乳汁纯化和加工过程中,因子VII转化为活化的因子VIIa
(3)入组标准与实验设计:
该研究评估了27位携带凝血因子抑制因子的A型或B型血友病患者。
(4)结果:
试验结果表明,对于轻度或中度出血事件,采用较低剂量(75 μg/kg)和较高剂量(225 μg/kg)Sevenfact治疗成功的比例约为86%
BMS和Acceleron Pharma宣布,FDA批准双方共同开发的红细胞成熟剂Reblozyl,用于治疗贫血
(1)公司:
百时美施贵宝(BMS)和Acceleron Pharma宣布,FDA批准双方共同开发的红细胞成熟剂Reblozyl(luspatercept-aamt),用于治疗极低至中等风险骨髓增生异常综合征患者中出现的贫血
(2)药物机理:
Reblozyl能够作为TGF-β的配体陷阱(ligand trap),防止TGF-β激活Smad2/3信号通路,进而促进晚期红细胞的分化和成熟
(3)入组标准与实验设计:
MEDALIST是一项随机双盲、安慰剂对照、多中心3期临床研究
(4)结果
:
在试验中,与接受安慰剂治疗的患者相比,在试验的前24周内,接受Reblozyl治疗的患
者中实现了至少8周RBC输注独立的比例显著增加,达到了研究的主要终点。
GSK宣布,其抗IL-5单克隆抗体Nucala在治疗伴有鼻息肉的慢性鼻窦炎患者的3期临床试验中获得成功
(1)公司:
葛兰素史克(GSK)宣布,其抗IL-5单克隆抗体Nucala(mepolizumab),在治疗伴有鼻息肉的慢性鼻窦炎(CRSwNP)患者的关键性3期临床试验SYNAPSE中,达到了试验的主要终点和关键性次要终点
(2)药物机理:
Nucala通过抑制IL-5信号通路,它有望减少嗜酸性粒细胞的生长,缓解多种因为嗜酸性粒细胞过多导致的疾病。
(3)入组标准与实验设计:
为期52周,随机,双盲的3期临床研究。
(4)结果:
与只接受标准疗法治疗的对照组相比,Nucala与标准疗法的联合治疗,使患者的鼻息肉大小在第49周和第52周都达到了统计学意义上的显著改善。
此外,该研究还减少了57%患者在52周治疗期内的首次手术需求,即该试验的关键性次要终点
Mesoblast公司宣布,美国FDA已接受其同种异体细胞疗法Ryoncil的生物制品许可申请(BLA)
(1)公司:
Mesoblast公司宣布,美国FDA已接受其同种异体细胞疗法Ryoncil(remestemcel-L)的生物制品许可申请(BLA),用于治疗类固醇难治性急性移植物抗宿主病(SR-aGVHD)儿童患者
(2)药物机理:
Ryoncil通过抑制T细胞增殖,和下调促炎细胞因子和干扰素的产生,来调节T细胞介导的炎症反应
(3)入组标准与实验设计:
3期临床试验结果显示,与既往实验对比。
(4)结果:
患者接受Ryoncil治疗后第28天的ORR为69%,与45%历史控制率相比,有统计学意义的显著增加。
在接受至少一次输注治疗且随访100天的患者中,患者的死亡率为22%。
而接受初始类固醇治疗无效的患者第100天死亡率高达70%

















