作者 l
放翁是水货
编辑
l
Alice
China Oncology Focus公司获得CFDA批准开展抗PD-L1药物的临床研究
1月29日,中国,Lee’s Pharm和Sorrento Therapeutics公司宣布CFDA已经批准China Oncology Focus公司开展Zkab 001治疗三种肿瘤的临床试验,Zkab 001是一种抗PD-L1单克隆抗体,由Sorrento公司授权进行大中华区药物研发的营销。此次的临床试验主要在北京肿瘤医院、中国医学科学院肿瘤医院研究所、武汉协和医院、上海市第六人民医院四家中心进行,着重评估药物的安全性和最大耐受剂量。

CHMP就HEMLIBRA®未来的临床应用给予积极的推荐
1月29日,日本,Chugai Pharmaceutical公司宣布罗氏公司已经获得通知,CHMP就HEMLIBRA®(emicizumab)的上市给予了积极的推荐意见,即可使用因子VIII抑制剂对血友病A患者的出血事件进行常规预防治疗。
自去年11月获得FDA批准上市以来,结合目前CHMP的积极推荐,HEMLIBRA®有望很快获得欧盟委员会的批准在欧洲上市。现有的治疗血友病A抑制剂需要每周频繁进行静脉注射,这极大地增加了临床护理工作,而HEMLIBRA®的优势在于仅需要每周进行一次皮下注射即可有效控制患者的出血事件,因此该药物的上市将会给患者带来更为显著的获益。
Innate Pharma和MedImmune公司达成临床项目合作
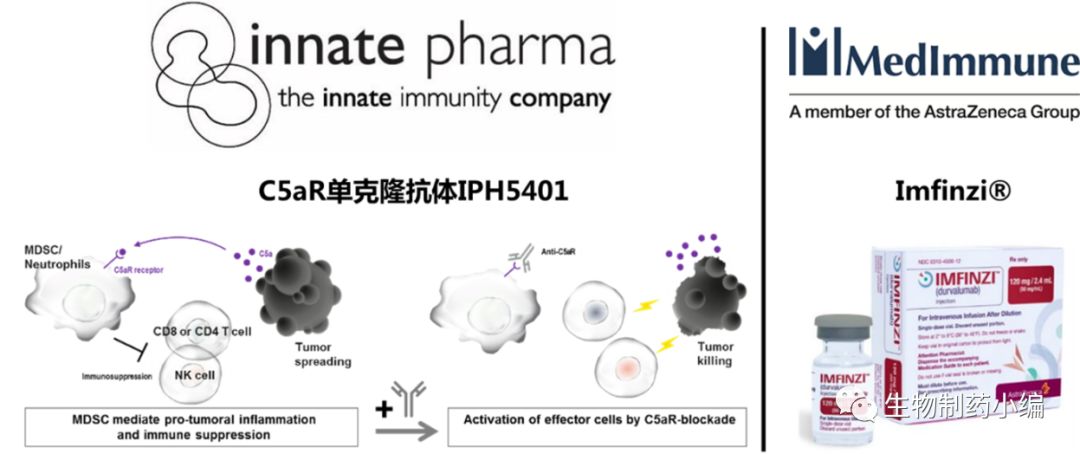
1月30日,法国,Innate Pharma宣布该公司就临床试验项目和MedImmune公司达成深度合作,共同开展一类新药IPH5401抗体联合Imfinzi®治疗实体瘤的I/II期临床研究,着重探究联合疗法的安全性和有效性,研究所需要的费用双方将平均分摊。
IPH5401是一种抗C5aR单克隆抗体药物,肿瘤微环境中的MDSC细胞会过表达C5a受体,预临床实验的数据显示IPH540可以阻断该受体的信号传导,提高免疫介导的肿瘤杀伤和检查点抑制剂的功效。
药明生物和Aravive Biologics公司达成深度合作共同推动新型抗肿瘤药物AVB-S6-500进入临床研究阶段
1月29日,中国,药明生物和Aravive Biologics公司联合宣布,基于主要候选药物AVB-S6-500的工艺开发、放大和cGMP制造取得的阶段性成功,因此两公司将进一步扩大其生物制品制造的合作。自与药明生物合作以来,有关AVB-S6-500从质粒构建到向FDA申请新药研发仅仅不到16个月,这样的速度可谓传奇,Aravive Biologics公司将进一步推进与药明生物合作,共同推进该药物进入临床研究阶段。
AVB-S6-500是一种新型生物药、是一种可溶性AXL受体制剂,目前正在开发针对急性髓系白血病(AML)和某些晚期实体肿瘤适应症(包括卵巢癌和乳腺癌)的靶向治疗。这种药物是GAS6受体的细胞外结构域与人IgG1 Fc结构域的融合物,可以以更高效的亲和力结合GAS6并降低或消除其刺激AXL途径的能力。前期研究表明,GAS6-AXL信号传导对于肿瘤生长和转移至关重要,同时该通路也参与肿瘤免疫逃避和对其他抗癌药物的抗性。预临床数据显示,AXL-GAS6抑制剂具有单药抗肿瘤活性并与多种抗癌药物联合
治疗
表现出协同作用。Aravive Biologics公司预计将在2018年第1季度启动该药的
I
期临床试验
。
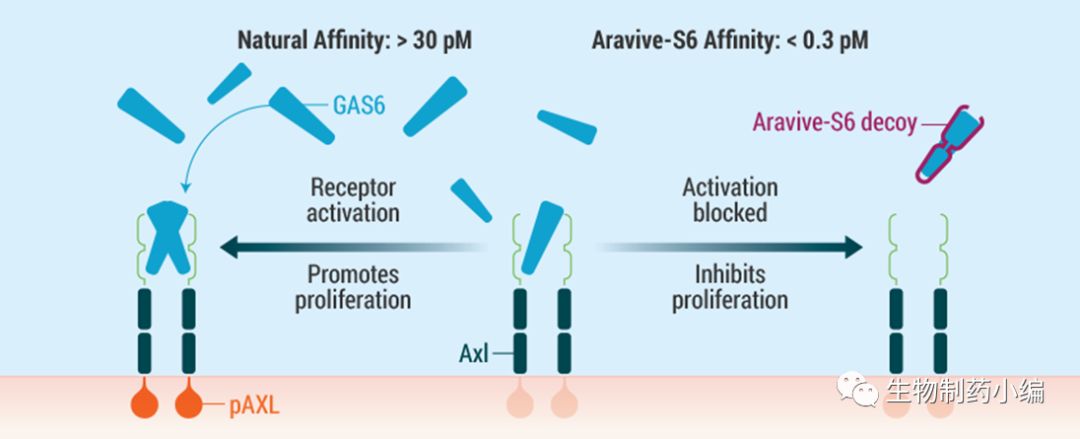 AVB-S6-500作用机制:阻止GAS6与细胞膜上的AXL结合,阻断AXL信号传导
AVB-S6-500作用机制:阻止GAS6与细胞膜上的AXL结合,阻断AXL信号传导
赛诺菲39亿欧元收购Ablynx以拓展抗体药物研发
1月29日,美国,Sanofi公司宣布和Ablynx公司签署了一项最终协议,赛诺菲将以约39亿欧元对后者进行收购。此次协议得到了赛诺菲和Ablynx董事会的一致认可。赛诺菲相信这项收购将进一步加强其在血液疾病中的竞争实力。
Ablynx是一家生物制药公司,从事开发纳米抗体蛋白药物。该公司在炎症,血液学,肿瘤免疫学,肿瘤学和呼吸系统疾病等各种治疗领域均有研发和合作项目。
纳米抗体是仅含有重链的抗体,其尺寸小,结构独特,其同时拥有常规抗体药物的优势和小分子药物的特性,在各种人类疾病中具有很大潜力。Ablynx在纳米抗体技术具有领先优势,可在专有的纳米抗体平台上快速生成和大规模生产。
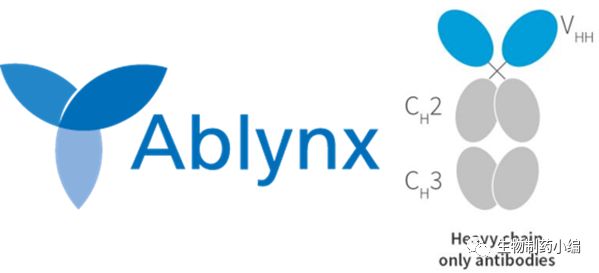
百济神州启动PD-1抗体Tislelizumab在食道鳞状细胞癌患者中的全球 III 期临床试验
1月31日,中国,百济神州公司宣布在一项评估其在研PD-1抗体
T
islelizumab(BGB-A317)作为晚期不可切除或转移性食道鳞状细胞癌(ESCC)患者的潜在二线治疗的全球 III 期临床试验中实现了首例患者给药。此外
T
islelizumab用于非小细胞肺癌和肝细胞癌患者的全球
III
期临床试验以及用于中国复发性/难治性经典型霍奇金淋巴瘤患者和尿路上皮癌患者的两项关键性 II 期临床试验也正在开展中。
食道鳞状细胞癌极具侵袭性,故患有晚期不可切除或转移性食道癌的患者,尤其是组织学分型为磷状细胞癌的患者往往预后较差。这是一项开放性、多中心、随机的
III 期临床
试验,该试验计划在大中华区、日本、韩国、比利时、法国、德国、意大利、西班牙、英国和美国招募大约450名患者。
百济神州
公司希望通过该 III 期临床试验确定Tislelizumab作为此类患者重要治疗方案的安全性和有效性。
Dermira启动了Lebrikizumab治疗中重度特应性皮炎的 IIb 期临床研究
1月31日,美国,Dermira公司宣布开始一项 IIb 期剂量范围的研究,评估Lebrikizumab治疗成人特应性皮炎的安全性和有效性。这是一项随机、双盲、安慰剂平行对照
IIb
期研究,旨在评估Lebrikizumab作为单一疗法与安慰剂相比的安全性和有效性,为中重度特应性皮炎患者 III 期治疗方案建立合适的给药剂量。
Lebrikizumab是一种新型的人源化单克隆抗体,可以高亲和力与IL-13相结合,特异性地阻断IL-13/IL-4受体的异二聚化以及随后的信号传导。IL-13是诱发特应性皮炎的核心调节因子,抑制该因子的信号传导可以有效降低机体炎症水平。
Immuron启动IMM-529治疗艰难梭菌感染的临床研究
1月31日,澳大利亚,Immuron公司宣布在一项评估其在研药物IMM-529治疗老年患者艰难梭菌感染的临床试验中实现了首例患者给药。艰难梭菌感染多发于使用过抗菌药物的老年患者,常引起艰难梭菌腹泻,严重者会危及生命。
这是一项安慰剂对照的
I/II 期
临床研究,计划纳入60名艰难梭菌感染患者,旨在评估IMM-529的安全性、耐受性和初步的临床疗效,初步疗效将通过症状的持续时间和严重程度以及与安慰剂相比的疾病复发率来评估。
IMM-529是一种口服的靶向艰难梭菌毒素B的多克隆抗体组合物,可以有效缓解感染者的临床表现并减少复发。有数据显示IMM-529进入胃肠道可以直接中和细菌毒素B,同时结合艰难梭菌孢子和营养细胞以防止进一步繁殖。并且IMM-529抗体在通过胃及大肠时仍能保持活性。
Affimed公布了两项AFM13治疗霍奇金淋巴瘤和CD30阳性淋巴瘤的研究进展
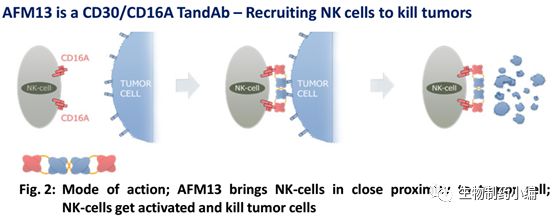
2月1日,德国,Affimed公司报道了有关其核心候选药物AFM13的两个独立临床研究的进展。这两项研究分别评估AFM13治疗霍奇金淋巴瘤和CD30阳性淋巴瘤的安全性和疗效。数据表明,AFM13耐受性良好,与抗PD-1抗体Keytruda联合治疗霍奇金淋巴瘤和作为单一疗法治疗CD30阳性淋巴瘤均显示出良好的治疗效果。在霍奇金淋巴瘤治疗方面,联合疗法的客观反映率高达89%,是PD-1单一疗法的两倍;对于1.5mg/kg剂量单药治疗CD30阳性淋巴瘤其客观反应率达66%。
AFM13是一种四价双特异性抗体,可以特异性结合肿瘤细胞上的CD30和NK细胞上的CD16A。目前正在进行淋巴瘤的临床研究,未来或可能拓展其它适应症。
Syndax宣布和阿斯利康进行肿瘤免疫临床试验合作
2月1日,美国,Syndax Pharmaceuticals宣布和阿斯利康就肿瘤免疫领域达成临床合作,共同探究阿斯利康的Durvalumab(PD-L1抗体)与SNDX-6352(Syndax的集落刺激因子1受体(CSF1R)单克隆抗体抑制剂)在各种实体肿瘤中的安全性和有效性。
SNDX-6352是一种靶向集落刺激因子1(CSF-1)受体的单克隆抗体。
抑制CSF-1受体的信号可以导致肿瘤相关巨噬细胞(TAMS)的细胞的耗竭,TAMS是在肿瘤微环境中的免疫抑制细胞,其可抑制淋巴细胞攻击和杀死肿瘤细胞的能力。SNDX-6352目前处在 I 期多剂量递增临床试验中,预计未来将开发用于治疗各种实体肿瘤和免疫相关疾病。
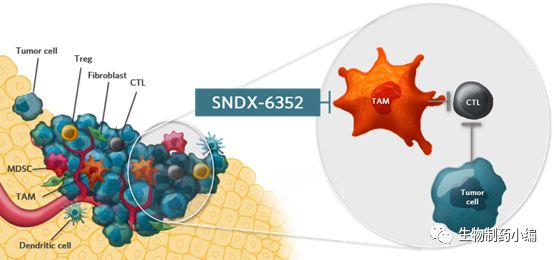
SNDX-6352可以诱导肿瘤相关巨噬细胞耗竭
PharmAbcine公司和MSD公司达成合作协议开启胶质母细胞瘤和乳腺癌的临床研究合作
2月1日,韩国,PharmAbcine公司宣布通过一家子公司与MSD达成合作协议,对PharmAbcine的抗VEGFR-2抗体TAC-0001联合MSD的Kembrolizumab在治疗复发性多型胶质母细胞瘤和乳腺癌疗效方面进行评估。
TAC-0001是PharmAbcine公司在研的靶向VEGFR-2的单克隆抗体药物。VEGFR-2在大多数恶性肿瘤如胃癌、肝癌、非小细胞肺癌、卵巢癌、脑癌、结直肠癌和乳腺癌中过度表达,是肿瘤血管生成的关键调节因子。抗PD-1疗法联合TAC-0001有望在某些实体肿瘤的治疗中取得突破性进展。
欢迎加入小编团队成为小编一员
请加 小编微信号:wuwenjun7237
如有技术解读、行业洞见愿意分享
欢迎投稿到小编邮箱:
[email protected]

















