

2017 Antibody Engineering & Therapeutics 现场速递一
美国当地时间12月12日,2017年Antibody Engineering & Therapeutics会议在美国加州圣地亚哥如期召开。作为抗体药物的权威学术会议,AET始终深入探讨抗体类药物的开发热点难点问题,逐渐成为抗体药物开发人士交流学习的盛会。今年AET会议从12月12-15日历时4天,由14个分论坛组成,从肿瘤抗体药物到其它神经退行性、抗炎症等抗体药物,从传统的CD20靶点到新型靶点,从第一代抗体药物形式到ADC药物和双特异性抗体,可以说本次会议全面覆盖抗体药物热点难点研发问题。
2016年华人抗体协会旗下的微信公众号对2016 AET进行全程报道,今年华人抗体协会(Chinese Antibody Society)受邀作为Antibody Engineering & Therapeutics 2017会议的官方媒体合作伙伴,继续全面参与会议的报道。

2017 AET会议盛况
2017 AET首天会议上午主要由四个keynote presentations拉开序幕,下午则由selecting antibodies against cell-surface targets novel antibody display和selection and screening technologies两个分论坛组成。第二天
上午的第一个track,延续了首天关于神经退行性疾病的主题,主要报告了治
疗性抗体在阿尔茨海默病和帕金森病等各种神经退行性疾病中的应用。第二个track是近年来火热的ADC药物主题。
作为对过去一年抗体药物研发的检阅,本届AET从前两天的会议报告来看就信息满满,受篇幅所限,以下仅对2017 AET前两天的几个重点报告进行报道。
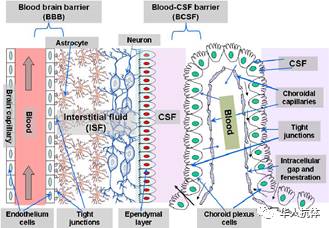
血脑屏障能够有效阻止有害物质物质进入脑组织中,但同时也会限制大分子药物的转运,不利于脑转移肿瘤及神经系统疾病的治疗。因此如何增加药物的脑内浓度是当前神经系统疾病治疗面临的一个重要问题。自上世纪60年代在电镜下确认血脑屏障的结构以来,50年来人类一直以来都在探索透过血脑屏障的物质,直到现在还没有一个能够透过血脑屏障的生物制药诞生。
带着40多年血脑屏障药物研发经验,UCLA的教授William M. Pardridge在本次大会上首先针对
血脑屏障透过抗体
研发现状做了详细的梳理,在下午的会议中Genentech的Dr. Jasi Atwal 则介绍了它们针对血脑屏障的双特异性抗体进展。
首先,中枢神经系统的给药方法主要分成两种,一种是直接给药(direct administration),一种是通过内源性转运体(endogenous transporter
)
使药物跨过
血脑屏障
。直接给药的方法中,最常用的一个途径就是convection enhanced delivery(CED)。CED是通过手术的方法直接把药物注射到大脑的特定部位。CED的主要优点是能够直接绕过
血脑屏障
,因此适应的药物范围相对比较广泛, 包括PVS-RIPO这样的一些病毒颗粒。另外,如同Dr Atwal提到的,对于一些蛋白类药物,如果它们本身
血脑屏障透过
能力不佳,那么在不改造结构的前提下,CED的给药方法可能会有助于提高药物疗效。这个方法的主要缺点是需要手术辅助给药,以及药物经过扩散后,在较远部位的局部浓度会变得稀释。
中枢神经系统给药的另一种方法是通过内源性转运体转运药物通过血脑屏障。这些转运体又进一步分为两类,一类是主要转运小分子的载体介导转运(carrier-mediated transporter ,CMT),一类是主要转运大分子的受体介导转运(receptor-mediated transporter,RMT)。
受体体介导转运
主要包括人胰岛素受体和转铁蛋白受体。一般来说,
血脑屏障透过抗体
大部分也是基于这两种受体研发的抗体融合蛋白。这些
抗体融合蛋白
因为可以结合
人胰岛素受体
,或者
转铁蛋白受体
,因此具有
血脑屏障透过
的性质。当它们携带上payload 的时候,能和payload一起穿透
血脑屏障
,因此又被比喻为“特洛伊木马”(如下图)。
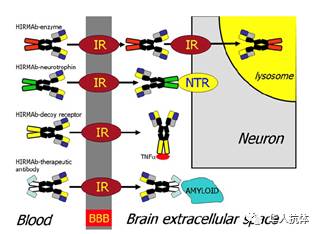
借助
受体介导转运的
血脑屏障透过抗体药物
Dr Pardridge指出,不同种类的payload对
血脑屏障透过抗体
的穿透程度有不同的要求。比如,当payload是TNFR 胞外区域的时候,那么这类的HIRMAB-decoy receptor protein只需要和内皮细胞胰岛素受体结合, 从而跨过
血脑屏障
进入interstitial fluid compartment即可(
如下图
),因为interstitial fluid compartment里面本身就含有靶点蛋白TNFa。但是当payload是溶酶体酶的时候,
人胰岛素受体
血脑屏障透过抗体
必须首先通过结合内皮细胞胰岛素受体跨过
血脑屏障
,然后通过结合神经元
胰岛素受体
内吞进入神经元细胞,最后还需要进入溶酶体才能发挥作用(
如上图
)。
药物透过血脑屏障过程
当payload自身也是个抗体的时候,这时就形成了
血脑屏障透过双特异抗体
。DrPardridge提到这类的双特异性抗体一般有四种结构(如下图)。第一种结构里,
血脑屏障受体抗体
和脑靶向抗体分别都是单价的。第二种情况,
血脑屏障受体抗体
是单价的,而
脑靶向抗体
是二价的。第三种情况,
血脑屏障受体抗体
和
脑靶向抗体
都是二价的,并处于蛋白的同一端。第四种情况,
血脑屏障受体抗体
和
脑靶向抗体
虽然也都是二价的,但是分别在蛋白的N端和C端(如下图)。在下午的会议中,Genentech的Dr Atwal 随后即带来第四种形式的双特异性抗体。
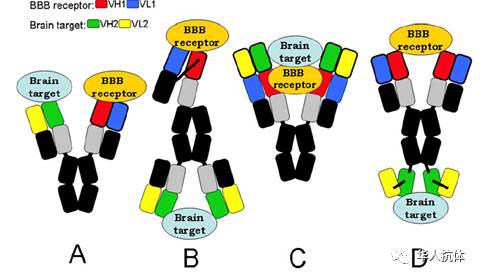
血脑屏障透过双特异抗体的形式
Dr.Pardridge 和DrAtwal都特别强调,对于
血脑屏障受体抗体
来说,它和
血脑屏障受体
的亲和力不能太高,也不能太低,这样才能有最好的
血脑屏障
穿透力。之前有人针对anti-TfR 抗体进行过研究,在抗体浓度较低的时候,TfR亲和力低的抗体(111nM)的
血脑屏障
穿透能力确实不如亲和力高的抗体(1.7 nM),因为亲和力低的抗体和TfR的结合能力弱。但是在治疗浓度(饱和浓度)的时候,无论对于低亲和力抗体还是高亲和力抗体来说,TfR的结合已经饱和了,因此TfR亲和力低的抗体的
血脑屏障
穿透能力反而比亲和力高的抗体强,因为低亲和力抗体和TfR解离得更快。
所以回过头来讲,
血脑屏障透过双特异抗体
之所以存在四种不同形式,其中一个重要原因就是
血脑屏障受体抗体
的位置和价数可以影响它们对
血脑屏障受体
的亲和力。如果
血脑屏障受体抗体
和
脑靶向抗体
都需要有很强的亲和力的话,那么上图中第四种结构可能更加合适,因为两种抗体都是二价的。如果
血脑屏障受体抗体
需要是一个低亲和力的抗体的话,那么上图中前三种结构可能更合适。第一种和第二种结构里面,
血脑屏障受体抗体
是单价的。第三种结构里面,
血脑屏障受体抗体
放在
血脑屏障脑靶向抗体
的内侧,因此空间位阻可能会造成里面的
血脑屏障受体抗体
亲和力下降。
同时在首天的会议中,来自苏黎世大学生化系的Dr. Andreas Plücktun教授讲了他们设计并使用 Adenovirus在体内直接生成生物分子药物,并旁秘性给药(paracrine delivery)的工作。
Plückthun教授讲到癌症等疾病具有异常的复杂性,例如肿瘤的异质性,不同的免疫检查点,信号通路等等。目前为止大部分药物研发聚焦在针对某一因子上,例如抑制一个免疫检查点。但是这些单一疗法通常容易因为肿瘤细胞clonal selection,而导致的抗药性等慢慢失去作用。所以在体内给多种复合药物来针对多个靶点/因子的疗法就显得很必要。一直以来此类疗法的一大障碍是复杂的监管,批审程序。
接下来,Plückthun教授展示了他研究组根据结构来设计的一种Adenovirus delivery system.(他们使用了最为广泛应用的Ad5 serotype的adenovirus,这种Adenovirus 与细胞表面的Coxsackievirus-and-Ad receptor结合。)他们使用Adenovirus因为其相对较大的载荷(35-36kb).这个Adenovirus delivery system使用不可自我复制的Adenovirus来瞄准目标细胞(可以是分裂中或不在分裂中的细胞),以确保安全性。目标细胞可以是肿瘤细胞,基质细胞,以及免疫细胞。他们设计的adenovirus可以同时携带多种治疗蛋白基因,并且精准控制payload.例如,Plückthun教授提到了他们的Adenovirus可以携带多种单抗的基因信息,感染肿瘤细胞,并把肿瘤细胞作为分泌单抗的“敌后工厂”。分泌出来的单抗可以直接在体内识别抗原。这种“鸡尾酒”方法也可以生产细胞因子(cytokine),从而改变肿瘤微环境。
Crystal structure of Ad5 knob/1D3 complex
接着,Plückthun教授总结了使用Adenovirus Delivery system的挑战:
1)必须是不可复制的病毒
2)要求有很高的特异性来识别目标细胞
3)防止Adenovirus与血液中各种成分和非目标细胞的互相作用
最后,Plückthun教授重点讲到了他们组针对提高Adenovirus识别特异性所作的努力。不管给药位置和途径,Adenovirus在给药过程中不可避免的会与非目标的正常细胞发生识别与作用,尤其是免疫系统的细胞。挑战在于去除Adenovirus本身的tropism,设计高效的针对目标细胞受体介导(receptor mediated)式的病毒摄入,并且确保病毒与受体之间有足够高的亲和力。
抗体偶联药物(ADC)经过了之前多年发展低谷的考验,历经多次技术更新,近些年,逐渐成为全球抗体药物研发的热门。值得注意的是,荣昌生物的RC48-vc-MMAE是我国的第一个CFDA批准进入临床试验的ADC药物,且取得了较好的I期临床数据。本次会议也是全面地从ADC药物的’A’, antibody, ’D’, drug, ’L’, linker 全方位讨论了抗体偶联药物的开发。尤为让人耳目一新的是Crescendo Biologics公司基于他们人源化VHdomain的Huma body 平台开发的新结构型ADC药物。
Dr. Brian McGuinness以公司的其中一个pipeline,CB108(PSMAtargeted HDC)详细介绍了这种ADC药物开发。由于Humabody VH fragments的分子量非常小,使得Human body 能够快速渗透到实体瘤,而外周循环系统中的药物则会被快速清除掉。这样既提高了tumor-to-blood ratio,又降低了系统毒性,从而增加了therapeuticindex。CrescendoBiologics公司的这种nanobody 型ADC药物以其独特的优势为今后肿瘤联合治疗的toolbox提供了新的选择工具。接着,Dr. BrianMcGuinness又介绍了其他几个pepeline,包括:monovalent nanobody, CB307(targeting CD317) ;双特异性nanobody, CB213(PD1xLAG3) ;biparatopicCB201 (PD1xPD1,blocker-anchor)。
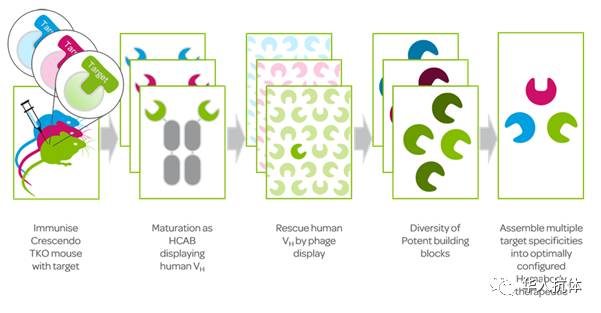
Crescendo Biologics人源化的Humabody VH fragment平台
(图片来源Crescendo Biologics公司网站)
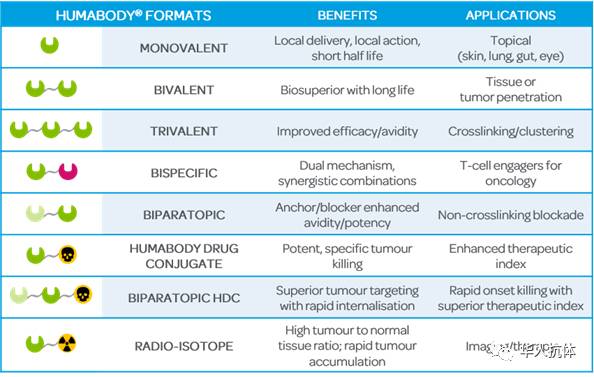
Humabody Drug Conjugate
(图片来源Crescendo Biologics公司网站)
第二天下午后的section继续分为两个主题:抗体的翻译后修饰对于抗体功能的作用和抗肿瘤抗体的肿瘤免疫治疗。抗体的翻译后修饰第一次在AET 会议上作为一个主题讨论,足以证明它的重要性。抗体药物作为生物大分子,与小分子药物不同,具有异质性特点。即使是FDA批准的抗体药物,或多或少都含有多种异构体。因此,结构的稳定性直接决定了抗体药物的质量。而抗体表达的翻译后修饰对于抗体的稳定性具有重要作用。抗体的糖基化修饰,氧化作用,糖化作用,脱酰胺作用,二硫键的连接等翻译后修饰成为评判抗体生物物理特性的重要指标。今天下午会议聚焦在抗体翻译后修饰对抗体功能的影响。
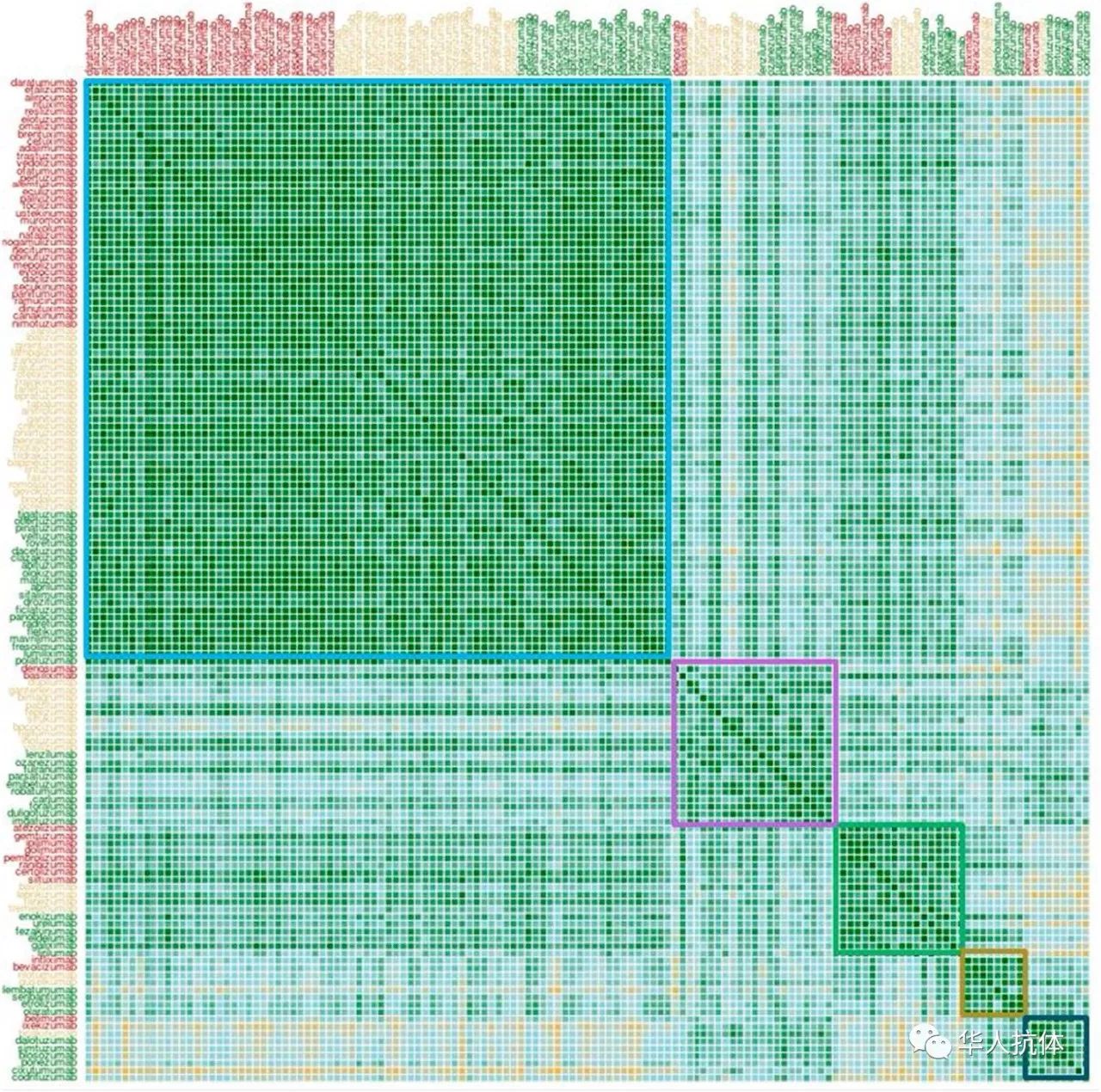
137种上市及临床阶段抗体根据物理化学性质的聚类分析图
Adimab的华人科学家Yingda Xu 博士展示了Adimab对130多种处于临床阶段抗体的翻译后修饰特点的全景式分析数据。通过检测并分析这些抗体的化学不稳定性位点,包括甲硫氨酸的氧化,天冬氨酸的异构化以及天冬酰胺的脱酰胺作用等,他们发现很大一部分已进入临床的抗体有一些理化属性仍然比较差,还有进一步优化的必要,CDR-H2和CDR-L1容易出现deamidation位点。这种回顾式研究为抗体开发中筛选临床候选药物提供了一定的指导,提高了抗体开发的成功率,也为biosimilar和biobetter的研发提供重要指导意义。
抗体Fc区域的糖基化修饰是抗体介导效应作用必不可少的翻译后修饰类型。糖基化的FC区域通过与不同类型的Fc受体结合,影响着下游促进炎症,抑制炎症以及免疫调节的功能。下午会议中,来自Stanford University 的华人科学家TaiaWang 总结了Fc 介导的各种不同类型的效应功能以及在感染,自身免疫疾病等疾病中的应用。抗体的Fc区域的开放和闭合状态取决于Fc上糖基唾液酸化。非唾液酸化的Fc有利于一型Fc受体的结合而不利于二型Fc受体结合,唾液酸化的Fc则恰好相反。
















