
药明康德/报道
自从上世纪80年代初重组人胰岛素上市之后,蛋白药已成为现代生物制药领域最重要的产品之一。之后的十余年成为蛋白药新品上市的黄金期,活性高、特异性强、毒性低的原研蛋白药不断涌现,21世纪蛋白药全球年度销售额已突破600亿美元。
但受限于蛋白筛选方法的技术瓶颈,本世纪以来问世的重磅蛋白新药开始减少,同时随着抗体开发技术的成熟,新靶点蛋白的发现已成为抗体药物研发的关键。今年6月北大天然药物及仿生药物国家重点实验室刘涛研究员团队与博后导师、Scripps研究所Peter G. Schultz博士团队合作,联合建立了包含近千种药用蛋白的分泌蛋白库,并基于该文库创建了逆转录病毒介导的高通量单细胞筛选方法,即旨在助力产业界开发更多治疗性蛋白以及抗体药的靶点。

▲刘涛博士与博士后导师Peter Schultz博士合影
刘涛博士基于在Scripps研究所进行的博士后训练,其成果集中在蛋白药物的筛选和改造,包括人源化牛抗体的开发、单细胞蛋白药物筛选平台的建立、以及蛋白和抗体药物的定点修饰(利用基因密码子扩展技术)等领域,希望通过最尖端的科技助推蛋白药物药理性质和生产工艺的升级换代。
逆转录病毒华丽转身 承载高效分泌蛋白筛选平台
药明康德:您和Peter Schultz教授团队合作建立的分泌蛋白库研究成果,近期在《细胞》子刊《Cell Chemical Biology》杂志发表。请您介绍一下该蛋白库的研究契机,以及分泌蛋白对新药开发最有代表性的助推方向。
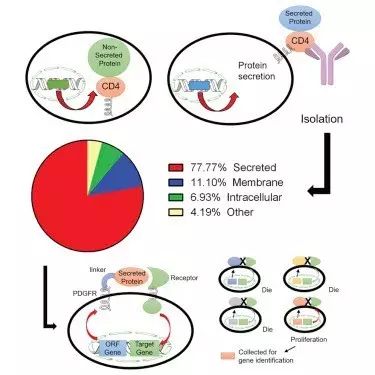
刘涛博士:核糖体合成蛋白质之后,会被运送到细胞内不同的细胞器发挥作用。胞内蛋白直接进入细胞器,并驻留在细胞内发挥作用。而另一类蛋白质则通过内质网膜进入内质网腔进行加工,之后又被转运到高尔基体内进一步加工,最终会被运送到细胞外发挥作用,这类蛋白叫做分泌蛋白。人类基因组中超过2000个基因编码分泌蛋白,约占整个基因组的10%,其中富含调控生命活动、具有重大药用价值的蛋白,包括激素、细胞因子、生长因子、趋化因子和蛋白酶等。
▲全新分泌蛋白文库(图片来源:《Cell Chemical Biology》杂志)
然而遗憾的是,目前大多数分泌蛋白的功能尚不清楚。有的蛋白在身体中发挥重要的正面作用,例如细胞分化、免疫调控等等;而有的异常蛋白则可能是刺激癌细胞异常再生的关键因素。如何寻找这些蛋白,是蛋白质药物开发的一个关键问题。例如,哪些蛋白异常表达会刺激肿瘤发育和迁移,哪些蛋白会调控造血干细胞的分化等等,我的团队目前正在关注这些研究方向。
过去针对分泌蛋白的筛选方法效率不高,严重制约了科学家们对全新药用蛋白和药物靶点蛋白的发现。目前各大药厂的蛋白质药物筛选办法基于96孔板或者384孔板,将蛋白一个一个放在多孔板里进行筛选,这样的筛选方式不仅耗费大量成本和时间,更重要的无法实现蛋白质组合的功能筛选和测定。其实在机体内,产生特异性功能的往往不是单一蛋白,而是两个甚至更多蛋白(或者蛋白亚基)的组合效应,如果使用多孔板来筛选数千个蛋白,根本无法做到组合效应的筛选。而在学术界,则由于成本的局限,几乎没有有效可行的办法来针对分泌蛋白的功能进行筛选。所以蛋白药物研发领域急需一种简便易行的高通量筛选模式,正是基于这些迫切的需求,所以我们打造了一种全新的分泌蛋白文库和单细胞筛选模式。
▲全新分泌蛋白文库(图片来源:《Cell Chemical Biology》杂志)
药明康德:请您介绍一下这个全新分泌蛋白库的呈现方式及其高通量筛选模式。
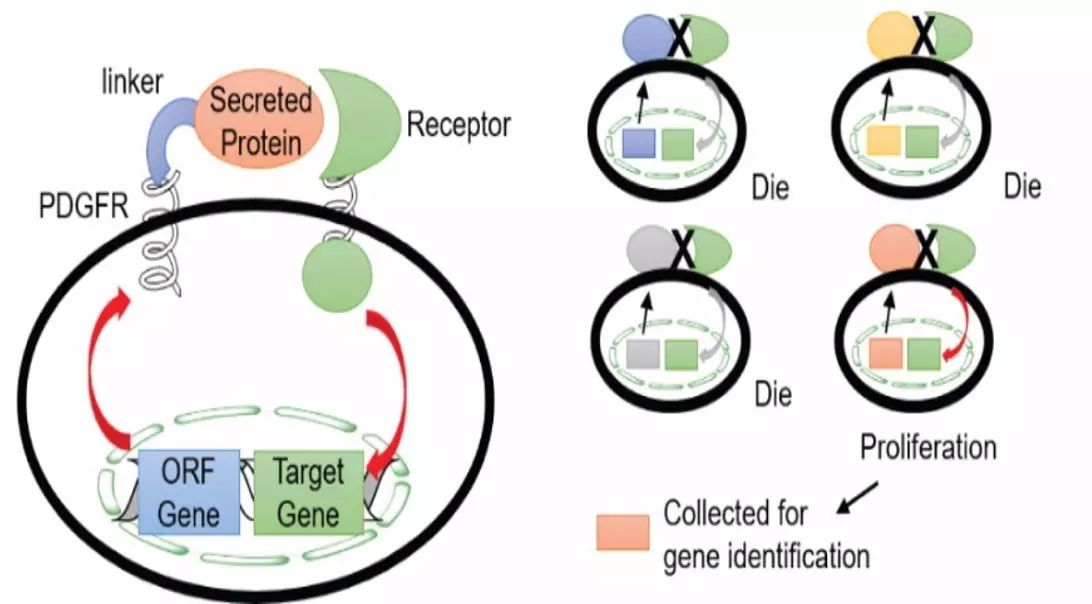
刘涛博士:我们首先用逆转录病毒科下的慢病毒(Lentivirus)来包装人类基因库。与其它逆转录病毒相比,慢病毒可以感染非分裂期细胞,容纳外源性基因片段大,其介导的转基因表达能持续数月,且不会产生可观察的病理学现象。由于该病毒包装的特性,我们可以轻易实现每一个病毒包含一个特定分泌蛋白的基因;之后再促使病毒感染靶细胞,并且使感染比例得到调控,最终实现一个病毒感染一个细胞。逆转录病毒的增殖模式,就是将自己的基因片段整合到宿主细胞的基因组之内,如果能够转录成功,则这个细胞就会增加一个特定的分泌蛋白的基因。通常我们会使这个蛋白基因带有较强的启动子,所以保证该特定蛋白的表达量较高。此外通过基因水平的改造,我们通过添加膜定位区将分泌蛋白固定在细胞膜上,从而实现了一个细胞一个基因的单细胞自分泌筛选。
因为细胞的尺寸非常微小,所以一滴液体内就可以包含数千个细胞,一个小指头大小的试管可以包含107个细胞,从而实现107种基因的筛选(确切的说是107蛋白质或者蛋白质组合的筛选)。以这种方式进行单一蛋白或者蛋白组合的高通量筛选,效率会大大提高。筛选出有功能的蛋白的几率,在理论上也会远远大于多孔板的传统筛选方法。此外这种基于逆转录病毒的高通量新型筛选系统,属于细胞水平的自分泌筛选系统,避免了蛋白的表达纯化,从而使成本降到微乎其微。
一方面我们希望基于分泌蛋白库,发现更多治疗性蛋白,丰富蛋白药物的种类。另一方面,我们课题已经建立起了抗体筛选平台,而抗体新药研发的关键就是靶点蛋白的开发,所以我们希望通过这个平台寻找新的抗体开发靶点,为中国新药研发奠定技术基础。
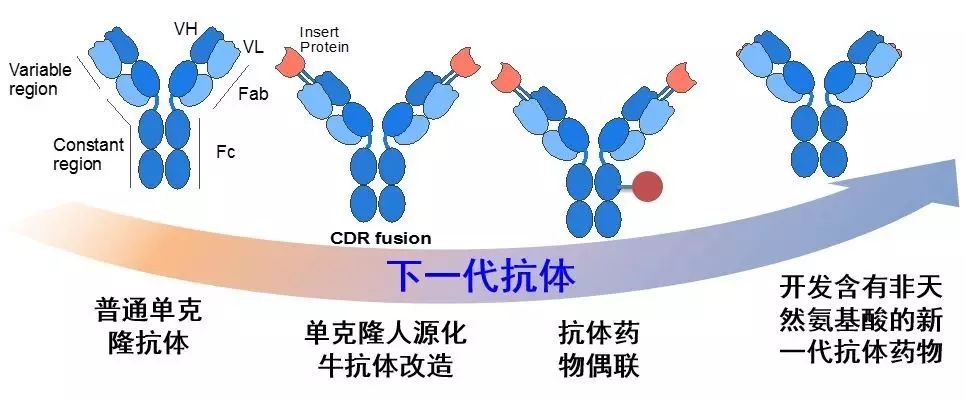
▲下一代抗体药物研发方向(来源:刘涛课题组)
密码子扩展技术:开拓氨基酸“智造”空间
药明康德:密码子扩展技术也是您近年来专注、并期待能运用于生物制药的尖端科技。这一技术宛如模拟造物主之手,来修改生命基础物质的产生与组合法则。请您介绍一下您这个方向的研究契机和最新进展。
刘涛博士:地球上绝大多数生物体内的蛋白质翻译过程,由61个密码子和3个终止密码子执行,其中61个密码子产生20种天然氨基酸并组成无数种不同的蛋白质。从自然进化的角度而言,多种密码子对应同一种氨基酸的简并性,以及3个密码子作为蛋白质终止合成的信号,似乎是一种碱基的浪费。我们猜想远古时代天然蛋白质可能由四五十种甚至更多氨基酸组成,但很多种氨基酸因为耗费能量过多所以被进化所抛弃;但也有可能原来只有十几种甚至只有个位数的氨基酸存在,但在进化的过程中逐渐增多。在实验手段不断丰富的今天,我们完全有能力利用尽可能多的氨基酸种类,丰富蛋白质的特点尤其是蛋白质的功能。
Peter Shultz导师课题组通过对蛋白的翻译机器进行改造,开发了全新的密码子扩展技术,将生物体内闲置的终止密码子变身为有义密码子,从而让生物体合成出含有21种甚至是22种氨基酸的蛋白。将这种密码子拓展技术应用到蛋白大分子制药领域,不仅可以利用多种功能团提升现有抗体药物的功能,实现生物药物的升级换代,甚至有望产生含有20种氨基酸的天然蛋白所不能实现的全新功能蛋白。
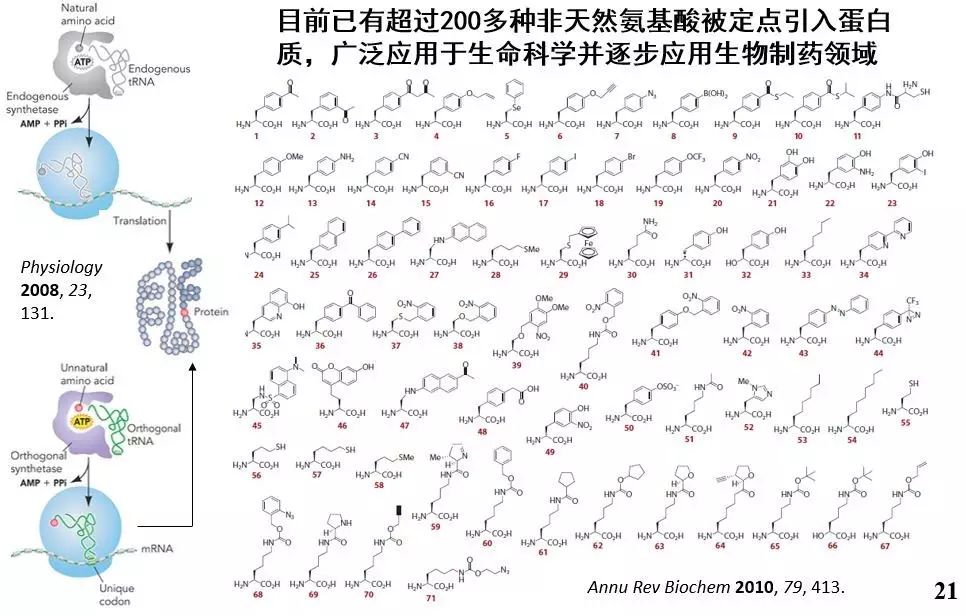
▲密码子扩展技术(来源:Annu Rev Biochem 2010, 79, 413.)
药明康德:和传统生物药相比,含有非天然氨基酸的全新蛋白质有哪些具体的应用价值?相应的蛋白药物又有哪些优势?
刘涛博士:多一种特定的非天然氨基酸可以发挥许多种功能。它可以形成组分更为丰富的蛋白质,我们有可能定点改造蛋白质的翻译机器,在重组蛋白、细胞内、甚至动物内产生超越20种氨基酸的蛋白质。
首先这种技术可以应用于蛋白质药物的定点修饰。天然蛋白质是20种氨基酸的组合,但能够进行化学交联反应的氨基酸种类却很少,常用的结合位点为赖氨酸。然而一般蛋白质会含有很多赖氨酸,例如抗体上存在40多个赖氨酸,如果我们想对抗体进行偶联修饰的话,那么偶联修饰物可能会被随机结合在这40个位点之中的任意一个。而如果我们将1个具有特殊反应活性的非天然氨基酸插入蛋白之中,则偶联反应只会发生在这个特定氨基酸所在的位置,从而实现可控的精准修饰。这种特异性修饰可以应用于蛋白质偶联药物,比如抗癌的抗体药物可以更好地靶向肿瘤细胞,将细胞毒素带到目标肿瘤;同时也可以应用于各种分子探针,使定点偶联的荧光基团更好地与大分子结合,形成稳定的观测效果等等。
另外蛋白质药物对于温度的敏感常常导致其构象变化,提高蛋白质热稳定性是蛋白质药物研究中的一个重要方向,而非天然氨基酸可以介导蛋白结构上的远距离共价交联,有望提高蛋白质药物的热稳定性。此外,通过引入非天然氨基酸,还可以定点、系统地研究蛋白质翻译后修饰(包括磷酸化、甲基化、乙酰化等等),这些修饰与细胞生命活动的调控和疾病的发生发展息息相关。
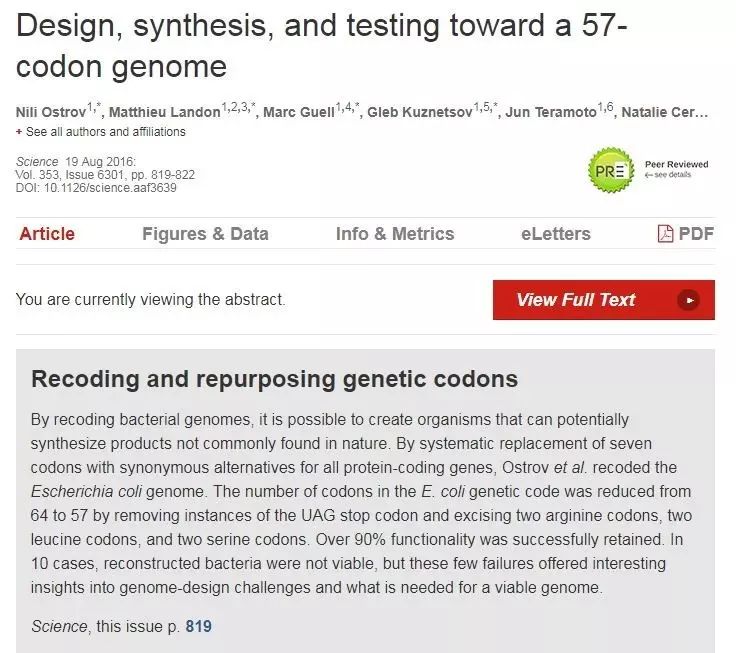
▲George Church教授团队改写大肠杆菌密码子数量(图片来源:《科学》杂志)
药明康德:目前密码子扩展技术主要聚焦于终止密码子的重新利用,您觉得该技术在未来还有哪些发展前景?
刘涛博士:重新编辑密码子除了激活终止密码子,从合成生物学的角度而言还有无限的想象空间。哈佛医学院George Church教授去年领衔完成了合成大肠杆菌基因组项目,只使用了57个密码子,其他7个密码子被空出来,有望实现多种不同非天然氨基酸的插入。天津大学元英进教授等的多篇《科学》论文中证明酵母基因组重新设计和全合成的可行性,标志着合成生物学发展的新高潮。随着合成生物学的发展,未来我们有望进化出含有多种非天然氨基酸的物种。此外,在生物医疗领域,北京大学周德敏教授利用终止密码子扩展技术重新编程了病毒基因组,产生依赖非天然氨基酸生长的活病毒疫苗,为未来开发HIV疫苗等奠定了技术基础。这些重编程的细菌、病毒、噬菌体等有望在生物医疗、生物能源、生物材料等等领域派上大用场。
所以从理论上来说除了3个终止密码子,其他密码子也有可能被节约后重新利用:同义密码子的数量可能被减到最小,非核酸物质也可能行使终止密码子的功能,也许有一天我们可以产生四五十种不同的氨基酸来参与蛋白质合成。当然如果要最终实现人工合成的蛋白质作为药物应用到临床,还需要稳定的合成方式来保证产量和质量。这些技术的实验和运用,甚至有朝一日实现人类基因组的全合成,需要化学生物学、细胞生物学、合成生物学多学科的共同努力。
名家师承 投身下一代抗体研发之路
药明康德: 在您学习成长的过程中,有哪些师长对您的学术生涯有过重要的影响?
刘涛博士:在我的成长中最大的影响来自父母,他们都是大学教师。我父亲是南开大学化学院院长刘育教授,他主要的研究方向是功能分子设计与合成、配位反应热力学、纳米超分子体系构筑。父亲的时光几乎都在实验室度过,每日早出晚归,几乎没有双休日和节假日,所以在学生中也有很高的人气。正是因为父亲的榜样作用,才让我从小就有成为优秀科学家的梦想。不过在专业领域方面,我选择了生物制药,我希望更近距离地关注人类健康。

▲刘涛博士与南开大学化学学院院长刘育教授合影
我非常感谢我的博士导师美国俄亥俄州立大学的Dehua Pei教授,是他带我进入了学术的殿堂,给我指明了科研发展的方向。对于我而言另一个重要的人生导师就是Peter Schultz教授,他本人是美国科学院及美国医学院院士,他也培养了很多美国科学院院士。此外北大药学院院长、清华药学院院长、北大化学生物学系主任也都是他的高徒。他更是9家科技及生物科技公司的创始人,率先将前沿分子多样性技术应用于能源、材料科学以及人类健康等领域。
在Peter Schultz导师的带领下,我在美国完成的最重要研究成果,就是在Scripps建立的人源化牛抗体工程技术。牛抗体是继羊驼抗体(又名纳米抗体)和鲨鱼抗体之后的第三个骨架不同于人的抗体。通过对牛抗体进行改造并且人源化,我们开发了一些列潜在的抗体药物,其中一款生长激素融合抗体,将生长激素在老鼠体内的半衰期提高了100倍,有望在人体内将生长激素一天一针的注射频率降低到一个月一针。我们希望未来还能将之应用于更多的药物类型,例如长效胰岛素等来帮助治疗2型糖尿病。
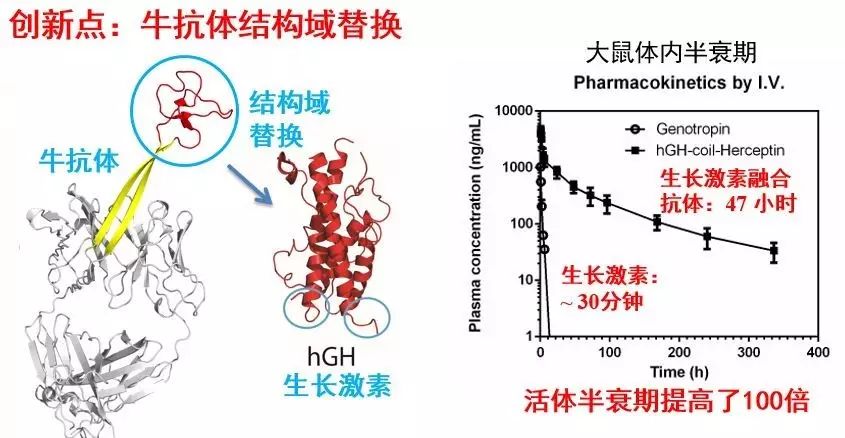
▲人源化牛抗体融合生殖激素(来源:刘涛课题组)
药明康德:在学术之外,您还曾有过哪些兴趣爱好?而除了以上您所谈过的科研领域,您还有哪些重要的研究经历?
刘涛博士:少年时代我的兴趣非常广泛,除了对科学具有浓厚的兴趣之外,我还喜欢旅游运动,在不少体育比赛中斩获过好名次,我曾经还一度是电子竞技的高手。我觉得与电子类相关的兴趣以及其他业余爱好,对于所有人而言都是智力开发的契机,但前提是要有自制力、能分清主次,不能让与主业无关的爱好占用太多时间和精力。人生的诱惑无处不在,酒不醉人人自醉,善加利用便是触类旁通的灵感,过度沉迷则是得不偿失的悔憾。如今有了自己的科研团队,少年时代的爱好已经逐渐淡出了我的生活,目前我的精力几乎全部放在科研上了,我觉得生命科学有太多的未解之谜,在这个知识大跃进的时代、科研转化从量变到质变的时代,我们应该把握机遇迎接挑战,完成时代赋予科学家的使命。

▲刘涛博士在美国滑雪场留影
我非常感谢北京大学药学院给我提供了报效祖国的机会,这里有着顶尖的科研平台,以及有张礼和院士、周德敏院长等一批杰出的前辈给我们指引方向。我现在所在的天然药物及仿生药物实验室隶属于北大医学部,所以除了基础科研之外,我还有机会与临床医生合作并肩投入大项目研究。基于纳米分子影像探针的癌症微创介入诊疗导航技术是国家973重点项目,我作为影像探针方向的骨干之一有幸参与研究,其中还有肿瘤专家、纳米材料专家和显微镜制造专家。目前我的课题组与几位肿瘤专家已经展开了合作,开发基于抗体和蛋白的肿瘤显像以及治疗等方面的工作。不论是基础科研还是大型合作项目,我都希望更好地利用自己的知识和现有资源,与其他领域的专家合作解决大众健康问题,亲身感受从基础科研到临床的转化,推进国计民生问题的解决。
















