一直以来,大家对干细胞的归巢性概念都不是很清楚,只知道是有这个概念。归巢,归哪个巢?是归受伤处还是归特定组织?归巢的机制是什么?归巢有何益处?今天,步步先生教你如何讲干细胞的归巢性才不会出错。
干细胞可以自己找到自己的“家”,而这个家是适合她自己生存的地方,就像识途老马一样,永远知道自己的家在哪里。这就是我们所说的“归巢”。她们可以从自己的家出来在外周血中“溜达”一圈,再寻找到并进入微环境适宜的“niche”中并定居其中,安居乐业。
要想全面了解干细胞的归巢性,首先我们得知道这个词是怎么来的。
概念:归巢(homing)
“归巢”(homing)最早是指循环在血液中的淋巴细胞倾向于迁移到它们原先派生自那里的淋巴细胞部位,如淋巴结,这一回归现象称为“淋巴细胞的归巢”,这是1983年Gallation提出来的 [1] 。后来“归巢”这一概念逐渐引申至干细胞。
干细胞归巢是指内源或外源性干细胞在多种因素的作用下,能定向趋向性迁移,越过血管内皮细胞至靶向组织并定植存活的过程,类似人体局部炎症反应后大量白细胞迁移至炎症周围。
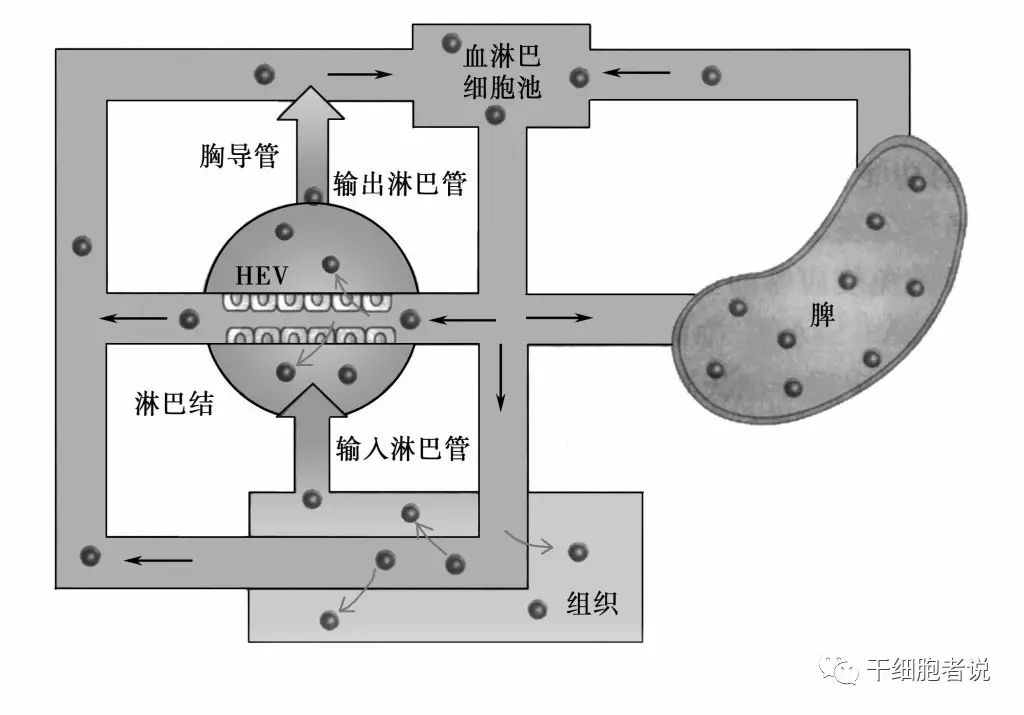
概念:干细胞巢(niche)
干细胞周围的细胞形成像摇篮样的环境保护着干细胞,这一环境被称为微环境(干细胞巢,niche)。niche不仅给干细胞提供养分,同时还指导干细胞的行动,决定干细胞的分化方向。微环境由和干细胞相邻的各种细胞、细胞外基质(extracellular matrix, ECM)以及多种细胞因子等构成。
除了造血干细胞之外,干细胞的归巢性主要是指的间充质干细胞。2009年,Krap等 [2] 建议将“间充质干细胞归巢”定义为:MSCs在目标组织的脉管系统里被捕获,随后跨越血管内皮细胞迁移至目标组织的过程。大量研究发现,当机体缺血、缺氧、损伤时,机体内或者外源性MSCs具有向损伤部位优势分布的特质。归巢是MSCs安全有效的应用于临床的关键。
微环境改变是MSCs 归巢的始动因素,组织损伤局部表达多种趋化因子、黏附因子、生长因子等各种信号分子。不同的微环境分泌不同的信号分子,吸引MSCs定向到达该组织。干细胞归巢,最终归巢至骨髓,归巢至各个脏器,归巢至炎症及创伤部位,甚至归巢至肿瘤部位。
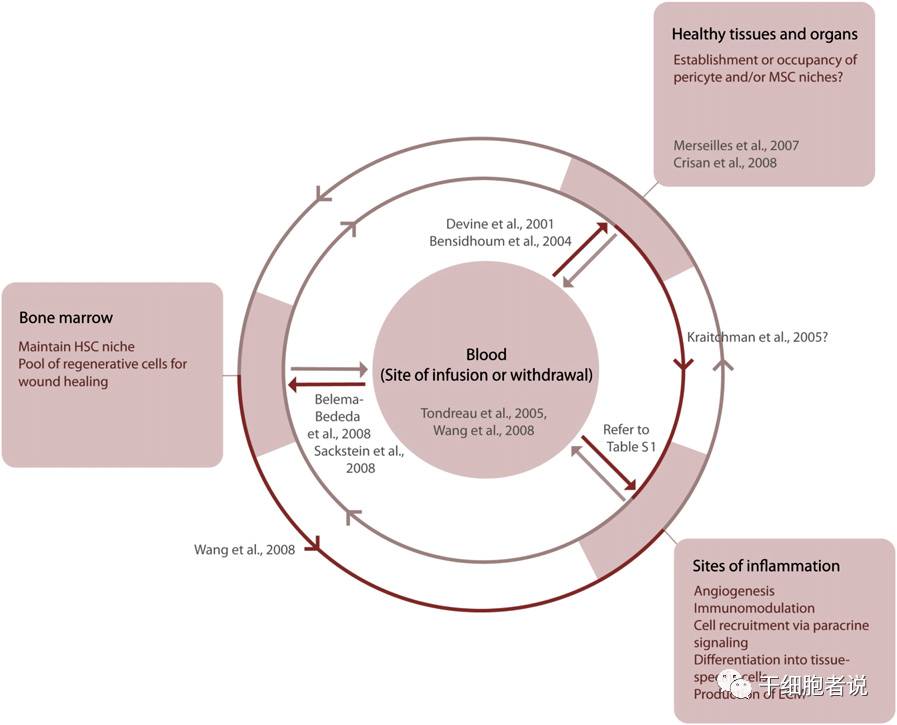
J.M.; Leng, T.G. . Cell Stem Cell 2009, 3, 206-216
图注:间充质干细胞在不同的解剖位置发挥着不同的功能。炎症反应包含创伤、慢性炎症反应(如移植物抗宿主病)和肿瘤等。[2]
一句话:干细胞归巢性, 犹如一部GPS,时刻指引着干细胞寻找回“家”的路。
干细胞的归巢机制具体尚不明确。简而言之,某些特定信号分子与MSCs膜上相应受体结合,共同驱动其归巢行为。移植的干细胞顺利归巢至微环境,这要求损伤部位的信号分子和MSCs表面受体相一致,这也是决定MSCs移植的成败之一。参与归巢行为的小组成员很多,有诸如趋化因子、生长因子和黏附分子等。
趋化因子:主要负责由远及近。
特定的组织分泌特定的趋化因子,并且通过趋化因子的浓度梯度,吸引带有趋化因子受体的细胞定向到达该组织。在损伤过程中,不同组织细胞能释放不同的化学趋化因子,这些趋化因子能促进MSCs迁移。以CXCR4受体为例,它一般只与CXCL12相结合。在骨髓含有较多CXCL12趋化因子,因此骨髓中的造血干细胞中经常可以发现CXCR4受体的存在 [3] 。一般而言,趋化受体能够感受外部环境趋化因子浓度,并引导细胞到达趋化因子浓度较高的地方 [4] 。
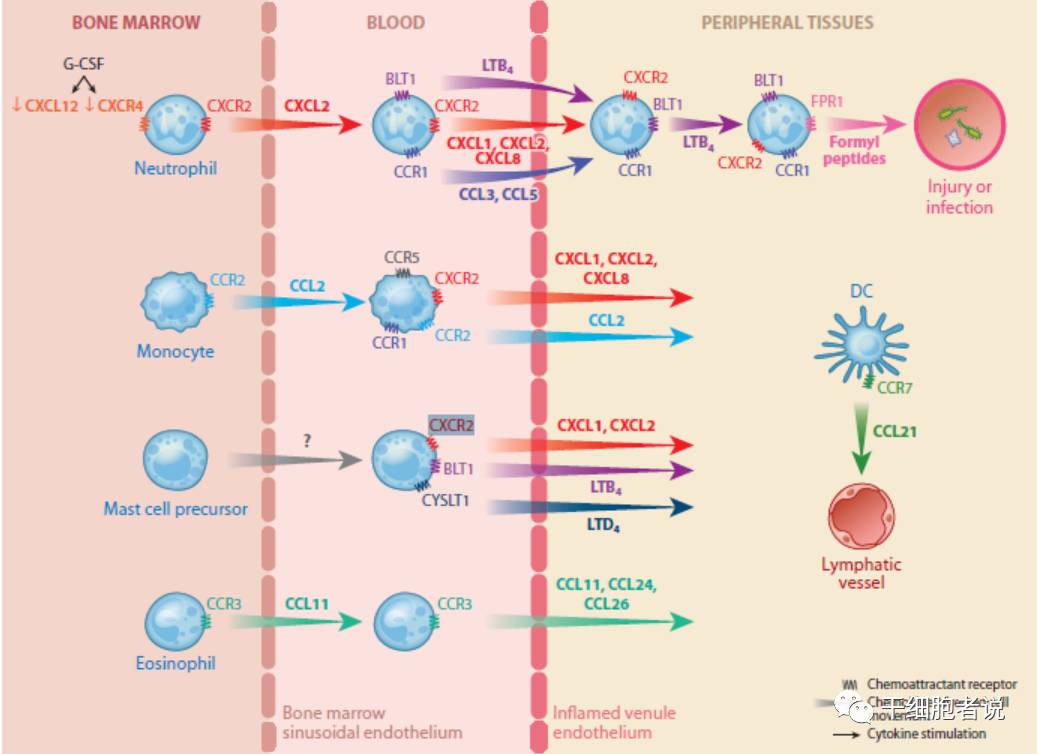
G, J ; S, L. ; Luster, Andrew D.Annual Review of Immunology, 2014, Vol.32, p.659-702
图注:炎症过程中骨髓,血液和周边组织之间的趋化因子交流。[4]
黏附分子:主要负责由外而内。
血管中的MSCs黏附于毛细血管壁跨内皮细胞层归巢至目标组织,MSCs和细胞外基质通过表达细胞黏附分子配体与细胞黏附分子结合,介导干细胞归巢到特定的靶点。
此外,炎症因子(如TGFα等)与生长因子(如HGF等)也是归巢小组的重要成员。
MSCs能够选择性归巢于多种组织的损伤部位,提高干细胞归巢率很重要。利用各种措施提高干细胞归巢的效率,将会提高干细胞移植的效果。
MSCs反复传代会导致其干性丢失,影响其治疗效果。MSCs在体外发生老化以及细胞间的氧化损伤积累,使细胞的增殖和归巢潜能有所减弱。
干细胞目前最主要的移植方式是动脉移植、静脉移植、局部注射移植。静脉回输常发生静脉阻塞于肺部而影响疗效,但胜在操作简单;动脉注射操作复杂,创伤大,出血多;局部注射归巢率高,疗效好。
黏附贴壁是移植干细胞存活、生存和有效的前提。研究发现,在移植前使MSCs的处于黏附贴壁状态会有利于移植后的细胞生存和向目标组织的归巢。所以,处于培养期的MSCs效果要比刚复苏后的MSCs效果要好。
移植时间及数量影响其归巢的效果,MSCs细胞越早期,移植后归巢率越高。如果数量够,不经过体外培养最好。Rombouts等 [5] 研究表明,新鲜分离的MSC较培养传代后的细胞归巢能力更强。MSCs培养24 h其归巢效率可从55%~65%降至10%,但对于刚分离出的MSCs往往数量稀少,通常要在体外进行大量培养扩增,以增加干细胞数量。 所以,移植时间与细胞数量也是一个矛盾。
重要参考文献:
Gallatin WM,Weissman IL,Butcher EC.A cel1.surface molecule involved in organspecific homing of lymphoeytes[J].Nature,1983,304(5921):30-34.
Karp, J.M.; Leng, T.G. Mesenchymal stem cell homing: the devil is in the details. Cell Stem Cell 2009, 3, 206-216.
Griffith J W, Sokol C L, Luster A D. Chemokines and chemokine receptors: positioning cells for host defense and immunity[J]. Annual review of immunology, 2014, 32: 659-702.
Ono S J, Nakamura T, Miyazaki D, et al. Chemokines: roles in leukocyte development, trafficking, and effector function[J]. Journal of Allergy and Clinical Immunology, 2003, 111(6): 1185-1199.
RomboutsWJ, PloemacherRE. Primary murine MSC show highly efficient homing to the bone marrow but lose homing ability following culture[J]. Leukemia, 2003, 17(1): 160–170.
归巢(homing):“归巢”(homing)最早是指循环在血液中的淋巴细胞倾向于迁移到它们原先派生自那里的淋巴细胞部位,如淋巴结,这一回归现象称为“淋巴细胞的归巢”,这是1983年Gallation提出来的。后来“归巢”这一概念逐渐引申至干细胞。
干细胞巢(niche):干细胞周围的细胞形成像摇篮样的环境保护着干细胞,这一环境被称为微环境(干细胞巢,niche)。niche不仅给干细胞提供养分,同时还指导干细胞的行动,决定干细胞的分化方向。微环境由和干细胞相邻的各种细胞、细胞外基质(extracellular matrix, ECM)以及多种细胞因子等构成。
作者:步步先生
本文系干细胞者说原创,经原作者授权转载
来源:干细胞者说 2017-07-17















