1、Cell Metab:首次治愈小鼠I型糖尿病
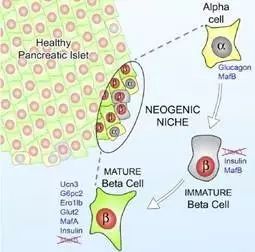
德克萨斯大学的研究者发现,胰腺的边缘区域中还持续存在着Ucn3阴性的非成熟型β细胞,它们是胰岛素α细胞和β细胞之间的相互转分化的中间阶段,可表达出功能上并不成熟的胰岛素。
因而研究者通过基因转移的技术,以病毒为载体,将靶基因导入胰腺细胞中,诱使非成熟型β细胞向成熟型β细胞进行转化。
由于基因转化后的β细胞与正常的胰岛β细胞在功能上并无区别,仅在血糖水平较低时生产并分泌胰岛素,则相较于传统胰岛素治疗方法和糖尿病治疗药物,该疗法最大的优势是可精确调控小鼠血糖水平。
另外,又因被改造的非成熟性β细胞本就是机体内长期存在的细胞,其免疫相容性较高,极大程度避免副作用的产生。
一般只有机体中至少80%的β细胞丧失其功能时,才会产生糖尿病症状,因而只需将20%的细胞恢复胰岛素分泌功能就有望治愈I型糖尿病。该疗法在小鼠生物模型中取得了喜人的成果。
研究者期望该疗法能在三年内达到人体临床试验的目的,但在此之前,他们必须先将治疗方法应用于大型动物研究中,预估耗资500万美元。
参考文献:Virgin Beta Cells Persist throughout Life at a Neogenic Niche within Pancreatic Islets
2、Diabetologia:Omega-3多不饱和脂肪酸(PUFAs)在糖尿病中显神威
芬兰国家健康与福利研究所的研究者通过对1997年至2004年间的7782名有遗传倾向的新生儿定期采血样检测进行胰岛细胞抗体(Islet cell autoantibodies,ICA)的监测,发现怀孕或泌乳期间母源性的Ω-3多不饱和脂肪酸(PUFAs)或能改变机体的免疫系统和炎性反应,能帮助保护高风险I型糖尿病(一种自身免疫性疾病)婴儿免于患病,因而研究者建议在母乳喂养期间增加鱼肉脂肪酸的摄入可减轻婴儿的自身免疫反应,降低I型糖尿病的发病风险
参考文献: Fatty acid status in infancy is associated with the risk of type 1 diabetes-associated autoimmunity
3、JCI:首次揭示Omega-3对糖尿病的分子调节机制
中国学者通过营养干预和基因治疗手段大幅度提高了I型糖尿病(non-obese diabetic,NOD)模型小鼠体内的Omega-3多不饱和脂肪酸含量,不仅使得NOD小鼠各项糖代谢指标恢复正常,也逆转了针对胰腺组织及细胞的自身免疫攻击。
深入研究后发现,Omega-3多不饱和脂肪酸可特异性抑制mTOR信号通路,并纠正了NOD小鼠Th17/Treg、Th1/Th2细胞的过度极化,从而发挥逆转自身免疫攻击的治疗作用。
另外,研究者还发现胰岛中发现有功能的新生β细胞,而且有大量的胰岛α细胞被转化成β细胞,促进胰岛功能的恢复和再生。这项研究除了对1型糖尿病具有显著的治疗意义,同样会使人数众多的2型糖尿病患者从中受益,摆脱对注射外源胰岛素的依赖。
参考文献:ω-3 polyunsaturated fatty acids ameliorate type 1 diabetes and autoimmunity
4、Cell Metab:刺激β细胞生长分化新通路
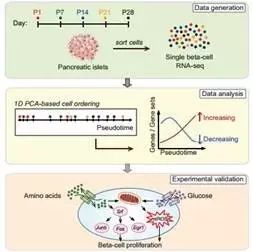
机体在子宫内时会产生β细胞,而在出生后也会继续再生,但随着年龄的增长,β细胞的再生减少。生长新型β细胞的主要途径是通过细胞分裂,但能够分裂的β细胞是罕见的,仅占全部β细胞的1%不到。因而,β细胞生长的分子通路的确定,为糖尿病的治疗提供了新思路。
加利福尼亚大学的研究者通过单细胞测序首次绘制了调节β细胞生长的途径,在分析了单个β细胞的分子特性和代谢活性,确定了分裂型β细胞与非分裂型细胞的分化方式。
即当未成熟β细胞在高代谢活性及活性氧和Srf / Jun / Fos转录因子的驱动下,可快速增殖分裂,因而可利用这些分子通路诱导β细胞再生。
参考文献:Pseudotemporal Ordering of Single Cells Reveals Metabolic Control of Postnatal β Cell Proliferation
5、AJHG:引发II型糖尿病的“根源”
II型糖尿病作为世界上最广泛和最具破坏性的代谢紊乱症,以前只有76个基因位点被确认。但是伦敦帝国理工学院的研究者在分析了包含5800名II型糖尿病病例受试者和 9691名对照受试者的欧洲和非洲裔美国人样本群体后,鉴定出了人类基因组中额外的111个2型糖尿病易感位点。
研究者还发现这111个易感位点与76个基因位点能够调节至少 266 个与所鉴定的疾病位点相邻的基因的表达。绝大多数这些基因位点被发现在基因编码区之外,但与在体脂中表达的调节这些基因的调节“热点”相吻合。
参考文献:High-Resolution Genetic Maps Identify Multiple Type 2 Diabetes Loci at Regulatory Hotspots in African Americans and Europeans
6、Cell Rep:STAT3基因突变可致使新生儿糖尿病
新生儿糖尿病(neonatal diabetes mellitus, NDM)是一种罕见的存在于不到6个月大的婴儿之间的糖尿病。它是由对β细胞功能或发育至关重要的基因发生突变造成的。目前已经确定约有20多种基因突变与NDM有关。
通常NDM患者并不产生与糖尿病相关联的自身抗体,但芬兰赫尔辛基大学的研究人员发现当患者出现STAT3基因突变(K392R)时,体内会出现较高水平β细胞抗体,且具有未充分发育的胰腺,随后会在不同的器官中出现多种自身免疫的临床表现。
参考文献:An Activating STAT3 Mutation Causes Neonatal Diabetes through Premature Induction of Pancreatic Differentiation
7、Cell: 新型抗糖尿病化合物问世
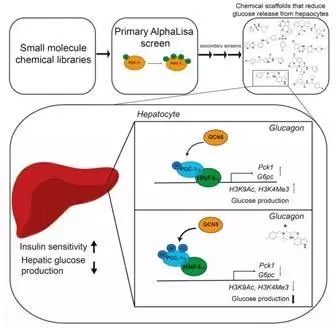
Scripps研究所和Dana-Farber癌症研究所的研究者通过筛选小分子文库来寻找能修饰PGC-1α蛋白的最佳活性物,结果发现了一类能减少肝脏葡萄糖产量的新型化合物SR-18292,可维持能量平衡,有助于控制参与能量代谢的基因;且它可调控PGC-1α蛋白的乙酰化修饰,来抑制肝细胞中的葡萄糖生成,达到抗糖尿病的目的,有望用以治疗糖尿病。
参考文献:small molecule screen identifies selective PGC-1α gluconeogenic inhibitors that ameliorate type 2 diabets
8、Cell Metab:胰岛细胞相转换,这两基因是关键!
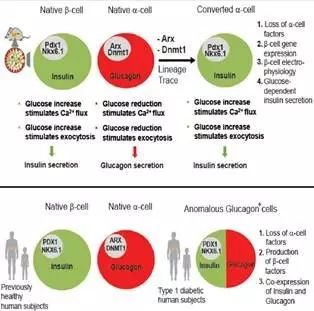
斯坦福大学医学院的一项研究显示,当小鼠胰岛α细胞中两个基因Arx和Dnmt1被抑制时,胰岛α细胞能被迅速和有效转为胰岛β细胞而产生胰岛素;这一点在人体细胞实验中也得以验证。因而,研究者也就能够利用胰岛细胞间的灵活性,来诱导人体内的胰岛细胞进行转化,从而减轻糖尿病的症状。
参考文献:Converting Adult Pancreatic Islet α Cells into β Cells by Targeting Both Dnmt1 and Arx















