2017
年
5
月
23
日,
FDA
加速批准
Keytruda
用于治疗成人及儿童的不可切除的或转移性的、微卫星高度不稳定(
microsatelliteinstability-high
,
MSI-H
)的或错配修复缺陷(
mismatch repair deficient
,
dMMR
)的、经治疗疾病进展和经氟嘧啶、奥沙利铂、伊立替康治疗疾病进展而无满意治疗选择的、
MSI-H/dMMR
的结直肠癌患者。
Keytruda
此次获批是
FDA
首个批准的基于特定基因背景的
Biomarker
而非发病部位的癌症疗法
,
Keytruda
可用于治疗
MSI-H/dMMR
的所有实体瘤患者,包括结直肠癌、胃癌、子宫内膜癌等等。
Keytruda与Opdivo的竞争
至发稿日,Keytruda与Opdivo各收获6个适应症,Keytruda赢下了最关键的非小细胞肺癌一线治疗。
|
Keytruda
|
Opdivo
|
|
黑色素瘤(
2014.09.04
)
|
黑色素瘤(
2014.12.22
)
|
|
非小细胞肺癌(
2015.10.02
)
|
非小细胞肺癌(
2015.09.30
)
|
|
头颈癌鳞状细胞癌(
2016.08.05
)
|
肾细胞癌(
2015.11.23
)
|
|
经典型霍奇金淋巴瘤(
2017.03.14
)
|
经典型霍奇金淋巴瘤(
2016.05.17
)
|
|
尿路上皮癌(
2017.05.18
)
|
头颈癌鳞状细胞癌(
2016.11.10
)
|
|
MSI-H/dMMR
实体瘤(
2017.05.23
)
|
尿路上皮癌(
2017.02.02
)
|
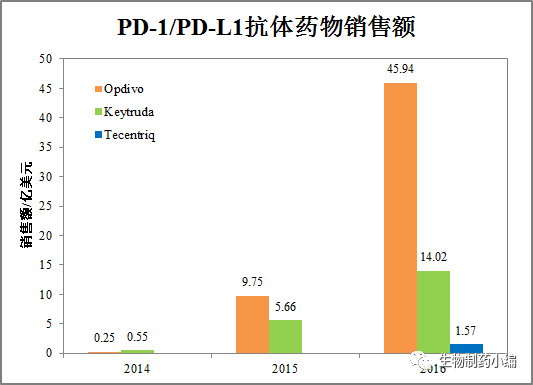
市场方面,Opdivo暂时占据优势,2016年销售额46亿美元,Keytruda为14亿美元,但两者差距在快速缩小。
专利方面,BMS获得全胜,和解协议规定
,
MSD首期将向BMS方支付6.25亿美元的费用,并将基于MSD的Keytruda从2017年至2026年的全球(包括美国、英国、荷兰、法国、德国、爱尔兰、西班牙、瑞士、澳大利亚和日本)销售额,持续支付6.5%(2017年1月1日-2023年12月31日)或2.5%(2024年1月1日至2026年12月31日)的许可费
。医药市场调研机构Evaluate Pharma预测,其在2020年的销售额将达到55亿美元。照此推断,
Keytruda的持续大卖将为BMS方带来至少30亿美元的进账
。更多信息参见:
生物医药的专利江湖:PD-1抗体
。
临床研究数据
Keytruda
此次获批基于
5
项临床研究中
149
例
MSI-H/dMMR
患者的治疗数据,包括
90
例结直肠癌患者和
59
例患有其他
14
种癌症之一的患者(计覆盖
15
种癌症)。治疗总体响应率
ORR
为
39.6%
,有响应的患者中
78%
的人疗效持续时间
6
个月以上。
11
人完全缓解、
48
人部分缓解,结直肠癌患者总体响应率
ORR
为
36%
,其他
14
种癌症总体响应率为
46%
。
MSI-H
用
PCR
方法检测、
dMMR
用免疫组化法检测,
149
例患者中有
14
例
MSI-H
患者是通过从
415
例临床研究的患者中通过回顾性分析肿瘤样本确定的(中心实验室开发的
PCR
方法)。
微卫星不稳定性
MSI
Microsatellites
是指分布在人类基因里的简单重复序列,包含单核苷酸,双核苷酸,或高位核苷酸的重复(小于
10
个),如(
A
)
n
或(
CA
)
n
。重复次数为
10-50
次。微卫星容易发生基因突变。
MMR
系统负责监督和纠正微卫星中产生的错误,具有高度保守性。
MLH1
,
MSH2
,
MSH3
,
MSH6
,
PMS2
是该系统中主要的蛋白,形成异二聚体相互作用。检测到错配时,
MSH2
与
MSH6
或
MSH3
相结合,
MLH1
与
PMS2
,
PMS1
或
MLH3
相结合。
MMR
系统出现缺陷会导致微卫星积累突变导致
DNA
错误,形成微卫星不稳定性
MSI
。
MMR
与
MSI
高度一致,一般认为
MSI-H
等同于
dMMR
。
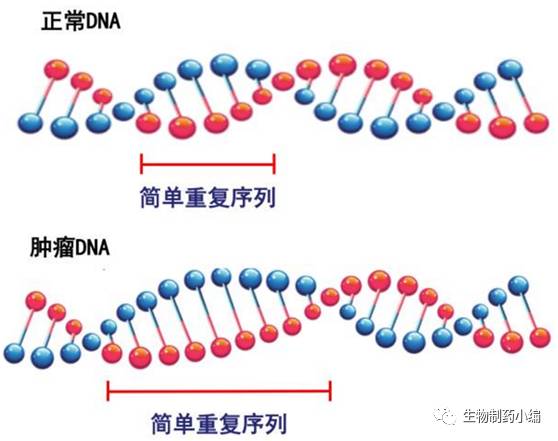
▲微卫星长度发生变化
检测方法上,通常用免疫组化
IHC
检测
MMR
的缺陷,基因型包括
dMMR
(
MMR-deficient
)、
pMMR
(
MMR-proficient
);用
PCR
方法检测
MSI
,基因型包括
MSI-H
(高度不稳定)、
MSI-L
(低度不稳定)、
MSS
(稳定)。
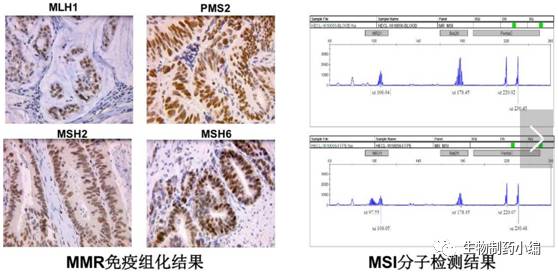
▲MMR与MSI的检测
MSI
最初在结直肠癌内发现,并被发现与预后相关,
NCCN
指南建议所有的结直肠癌患者都要检测
MSI
。

NCCN
指南推荐
PD-1
免疫治疗单抗
pembrolizumab
和
nivolumab
用于

















