基于
UDI
的医疗器械精细化管理实践及应用规范化探讨
余冬兰,吕晓慧,姜爱国,钟美红,缪家清,吴丽华,朱庆棠
摘要
目的:
介绍国家首批试点医疗机构通过医疗器械唯一标识(UDI)进行医疗器械精细化管理的实践方案,并提出UDI在行业应用实践环节需进一步优化规范的内容。
方法
:通过对国内UDI应用现状和趋势分析,结合医疗器械管理的相关规定及政策要求,阐述我院以UDI为基础建立的医疗器械全生命周期精细化管理的具体做法及优势,并通过具体案例对实践中遇到的问题进行了分析,提出UDI应用层面规范性建议。
结果和结论
:我院实践经验表明,UDI可以满足医疗机构对于医疗器械精细化管理的需要并符合未来的发展趋势,同时需要行业共识与规范化推进才能更好地为医疗器械行业数字化转型提速增效。
医疗器械唯一标识(unique device identification,UDI)是对医疗器械全生命周期赋予的身份标识,是医疗器械上市流通使用的唯一“身份证”。UDI的使用将极大促进医疗器械产业数字化建设和质量安全建设,提高供应链透明度和运作效率,降低运营成本,实现多方信息共享与交换,推动医疗器械高效监管和价值医疗内涵建设。2019年5月,国务院办公厅印发《深化医药卫生体制改革2019年重点工作任务》,要求落实“制定医疗器械唯一标识系统规则”;同年7月,国务院办公厅印发《治理高值医用耗材改革方案》,在加强高值医用耗材规范化管理方面,再次强调“制定医疗器械唯一标识系统规则”。国家药品监督管理局联合国家卫生健康委员会迅速开展了UDI系统试点工作,并于同年10月正式发布《医疗器械唯一标识系统规则》(以下简称《规则》),正式开启了我国UDI的实施进程。2020年12月,国务院常务会议通过《医疗器械监督管理条例(修订草案)》,增设产品唯一标识追溯、延伸检查等监管措施,意味着UDI即将纳入医疗器械管理相关法律规定。2021年1月7日,上海市药品监督管理局、上海市医疗保障局、上海市卫生健康委员会联合印发《上海市关于联合推进医疗器械唯一标识系统全域试点工作方案》,旨在加强三医联动,进一步提升医疗器械全生命周期监管效能和医疗卫生管理效率。随着2021年1月1日第一批产品正式实施UDI和更多产品的逐批推进,以及UDI在医药、医疗、医保等领域的逐步衔接应用,将对医疗器械行业,特别是医疗机构器械的使用管理产生重要影响。如何发挥UDI的优势,并将UDI应用在医疗机构医疗器械全生命周期管理的精细化建设和质量安全建设,提高医疗管理效率,降低运营成本,实现多方信息共享与交换,推动医疗器械高效监管和价值医疗内涵建设,是各医疗机构所关注的。
本研究结合我院基于UDI的医疗器械精细化管理实践,阐述了UDI在医疗器械全生命周期重点管理环节的实施方案和管理优势,并结合应用环节存在的相关问题进行规范化建议和探讨,旨在加速UDI的落地应用,并更好地发挥UDI在三医联动中的核心作用。
1 我院UDI实施方案和管理优势
2011年起,我院率先实施基于UDI的医疗器械精细化管理,从植介入类高值耗材的追溯管理入手,是国内最早应用UDI进行医疗器械精细化管理的医疗机构之一,并于2019年入选全国首批UDI系统试点使用单位。我院以UDI为核心对医疗器械(医用耗材)管理进行了系统性建设和流程再造,这一过程对医疗器械(医用耗材)供应链流转、质量安全监管、管理精细度和效率提升、运营成本管控等都产生了革命性的影响。
1
.
1
编码体系
长期以来,全球医疗器械没有统一的医疗器械标识,生产企业、配送企业、医疗机构采用不同的编码体系对医疗器械进行管理。2011年,在全球协调工作组(Global Harmonization Task Force,GHTF)/国际医疗器械监管者论坛(International Medical Device Regulators Forum, IMDRF)的推动下,产生了采用“医疗器械唯一标识(UDI)”对上市后医疗器械实施监管的统一要求。2011年,国内外仍未有指导性的UDI系统框架,但相关研究表明当时我国已经具备了统一实施UDI的市场环境,因此我院选取了国际上较为通用且产品应用范围较广的编码构建院内UDI编码体系,包括了国际物品编码组织的GS1(Globe Standard 1)编码和美国卫生行业商业交流委员会(Health Industry Business Communications Council,HIBCC)的HIBC编码,这与美国FDA及欧盟委员会后续认可的相一致。自2011年年底开始,我院逐步要求在院及新增的医疗器械产品内外包装的标识上具备GS1或HIBC编码。而根据国家药品监督管理局2019年发布的《规则》,其认可的发码机构及对应编码有3种,分别为中国物品编码中心的GS1编码、中关村工信二维码技术研究院的MA码(IDcode)以及阿里健康科技(中国)有限公司的AHM编码。我院也在逐步将后续两种编码纳入院内UDI编码体系。截至2020年12月31日,我院全院在用医疗器械(医用耗材)品目数40 268条,UDI覆盖率100%,其中GS1编码覆盖率98.19%,HIBC编码覆盖率1.81%。2012—2020年两种编码覆盖情况如图1所示。
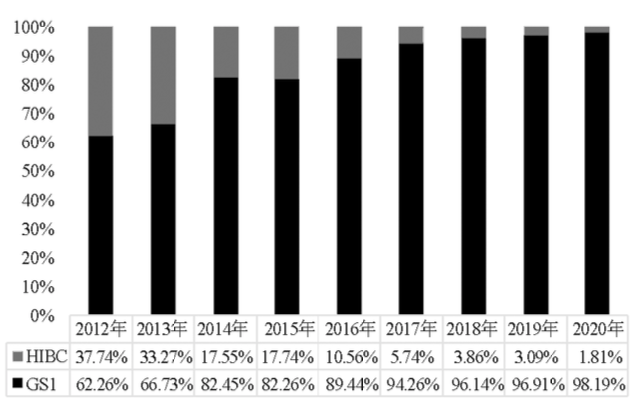
图1 2012—2020年我院GSI编码与HIBC编码产品覆盖率
UDI包含了两个部分,即产品标识(device identifier,DI)和生产标识(production identifier,PI),其中DI作为UDI中的静态部分标识了产品的生产厂商及规格型号,PI作为UDI中的可变部分标识了产品的生产批号、序列号、生产日期及失效日期等信息,完全可以满足医疗机构对医疗器械的唯一性识别和精细化管理的需要。对比医疗机构自编码,其核心优势在于:①UDI为原厂编码,可以确保医疗信息的真实性和可靠性。如使用医疗机构自编码,一旦赋码错误,会引发后续一系列的医疗差错和经济差错;②可以优化管理成本。医疗机构自编码需进行二次编码和赋码,需耗费大量人力和物力;③可以解决多级包装唯一码问题。如产品为多级包装,一旦粘贴医疗机构自编码的外包装丢失,包装内的所有产品将无法通过自动识别与数据采集(auto identification and data collection,AIDC)方式识别,导致管理混乱。
1
.
2
数据载体
UDI数据载体是UDI体系的重要组成部分,也是医疗机构利用UDI进行医疗器械信息化管理的重要抓手。UDI数据载体必须要满足AIDC以及人工识读的要求,通常有一维码、二维码及射频标签(radio frequency identification,RFID)等形式。我院在建立UDI管理体系之初,一维码为主要的数据载体,医疗机构可以通过条码扫描设备完成医疗器械的自动识别与数据采集,一定程度提升了医疗机构的管理效率。但由于医疗器械生产标识PI部分通常包含了较多的字段信息,当DI和PI串联且条码过长时,经常会发生不能识别的情况,而且串联通常要占用比较大的空间(见图2);也有生产企业采用并联方式(见图3),通常DI设置1条,PI设置1~3条,虽然可以解决识别问题,但会降低识别与数据采集效率。

图2 DI和PI串联

图3 DI和PI并联
二维码是近几年快速兴起的数据载体,最大的优势在于所占包装空间较小、信息集成度高,目前在一些对空间要求较严格的医疗器械外包装或本体上应用较多,以Data Matrix、QR Code较为常见(见图4)。二维码可以一次扫描就完成全部数据的采集,效率较高,但是需要专用的二维码扫描设备。由于医疗器械一维码和二维码都为主流数据载体,建议医疗机构选取兼容一维码和二维码的扫描设备,同时也要考虑设备本身识别编码的类型。
 图4 二维码(Data Matrix 及QR code)
图4 二维码(Data Matrix 及QR code)
随着医疗机构对于医疗器械智能化管理的提升,有部分医疗机构采用智能柜、智能屋等自动感应的非扫码方式管理医疗器械,这就需要医疗器械本身包含或粘贴RFID标签。由于RFID标签实施的费用较高,同时抗干扰能力较弱,生产企业较少采用RFID标签,目前多为物流配送企业为了配合医疗机构进行医疗器械RFID管理,入院前粘贴RFID标签。
建议生产企业根据产品特点选取合适的UDI数据载体,通常外包装中要包含主流的一维码或二维码载体,方便医疗机构在院内流转各环节进行AIDC,也可配合相应的自动感应场景增加RFID标签。如产品为可重复消毒使用的手术器械或植入器械,建议生产企业增加二维码本体标识,方便医疗机构在使用过程中,特别是当包装标识和本体脱离时,可以进一步通过AIDC方式管理医疗器械。目前也有生产企业尝试在手术器械本体中增加RFID标签,便于通过RFID识读设备快速识别并提取相关信息。总之,RFID标签目前还处于探索应用阶段,建议与一维码或二维码结合使用。
1
.
3
UDI数据库及平台系统建设
UDI数据库是UDI系统的重要组成部分。按照《规则》要求和《医疗器械唯一标识系统试点工作方案》的安排,我国医疗器械唯一标识数据库(unique device identification database,UDID)于2019年12月10日正式上线,面向试点企业开放针对试点品种的唯一标识相关数据申报功能。对于第一批试点+实施目录中的产品,2020年10月1日(后调整至2021年1月1日)起生产的医疗器械,在其上市销售前,注册人应当按照相关标准或者规范要求将最小销售单元、更高级别包装的产品标识和相关数据上传至UDID。而美国FDA建设的全球医疗器械唯一编码数据库(global unique device identification database,GUDID)于2014年6月出台相关指导原则,所有医疗器械厂家必须遵照原则建立UDI并提交相关信息备案。UDI数据库中仅包含DI主条码信息,并通过DI作为主键关联该医疗器械的其他相关信息,与我国UDID和美国GUDID建立的方法类似。我院从2011年年底开始通过第三方互联网标准数据服务平台,要求以生产企业、经营/配送企业、医疗机构和平台服务商共建数据库的模式建立我院的医疗器械UDI数据库,目前仍保留该模式,但预留了接口与UDID进行对接。具体模式见图5。
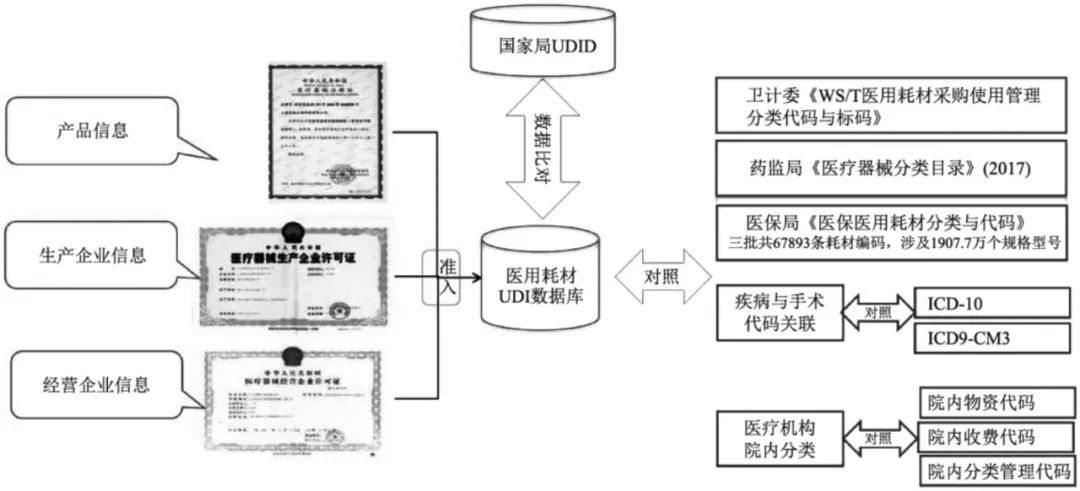
图5 我院医疗器械UDI数据库建立模式
①生产企业:负责向数据服务平台填报完整标准化的产品及企业信息,如产品名称、规格型号、DI信息、完整注册证信息、生产企业名称等,生产企业必须对填报数据的真实性、准确性及完整性负责;同时根据实际产品授权情况向下级经营/配送企业进行平台产品授权;生产企业也可直接向医疗机构供货,操作同经营/配送企业。
②平台服务商:负责对生产企业提交的产品完成DI信息与国家、行业等医疗器械应用分类编码的映射,如医疗器械分类编码、医保医用耗材分类代码等。
③经营/配送企业:负责首营证照的维护,以及根据上游生产企业在数据服务平台填报的授权产品,选取已获医疗机构准入的产品,并补充医疗机构收费编码、院内分类管理代码、产品价格等信息,完成后提交医疗机构审核。
④医疗机构:负责通过数据服务平台对企业提交的产品信息和分类进行审核,并将审核后的产品信息补充至医疗机构医疗器械UDI数据库。
目前我院医疗器械(医用耗材)UDI数据库有备案生产企业402家,经营/配送企业310家,产品目录40268条,覆盖我院全部医疗器械(医用耗材),所有企业首营证照管理及产品信息更新维护都通过数据服务平台,经医疗机构审核后纳入医疗机构医疗器械UDI数据库管理,同时所有产品都可以通过产品外包装自带的原厂UDI码以AIDC的方式在院内流通管理。该模式的核心优势在于:企业证照首营信息及产品信息的初始化及更新可以高效精准完成。企业和产品信息的初始化及日常维护由医疗机构物资管理部门转移至生产企业、经营/配送企业和平台服务商,且产品信息经过了生产企业、经营/配送企业、平台服务商及医疗机构层层确认,最大程度地保障了产品信息的真实性、及时性、准确性及完整性。同时平台上的信息可以提供给多家医疗机构共享,以UDI为核心实现信息共建共享的同时也提升了供应链整体运作效率和精准性。
1
.
4
基于UDI的医疗器械(医用耗材)全生命周期精细化管理
根据《医疗器械监督管理条例》《医疗器械使用质量监督管理办法》及《医疗机构医用耗材管理办法(试行)》等法律法规的要求,医疗机构应当加强医疗器械信息管理,建立医疗器械及其使用信息档案,鼓励医疗器械使用单位采用信息化技术手段进行医疗器械质量管理,实现每一件医疗器械的全生命周期可溯源。医疗器械管理核心环节主要涵盖验收、使用、收费结算及监测管理等环节(见图6),每一个环节都可以通过UDI实现医疗器械的精准高效管理,管理粒度可以精细至每一个批次甚至每一个序列号产品。
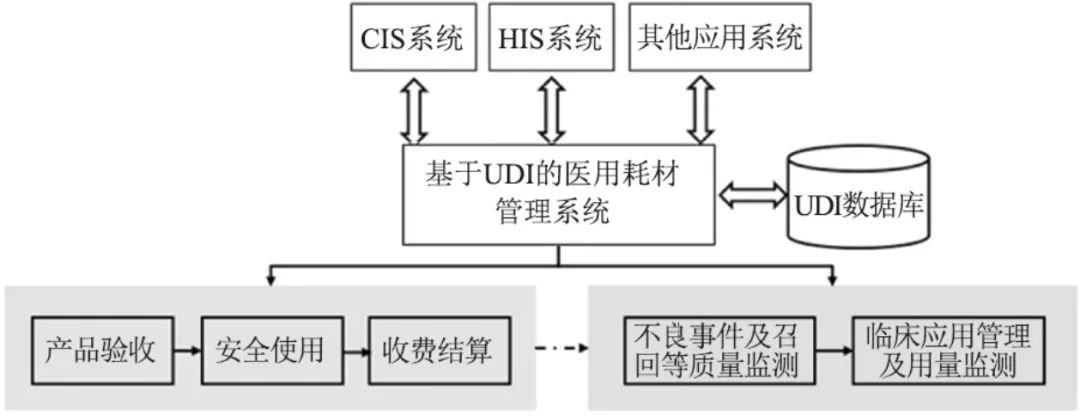
图6 基于UDI的医疗器械(医用耗材)管理系统
1.4.1
产品验收
产品验收是医疗器械管理的重要关口环节,医疗机构应当真实、完整、准确的记录进货查验情况,重点对医疗器械是否符合遴选规定、质量情况、效期情况等进行查验。在医疗器械验收入库时,需将有关信息录入信息系统。信息内容至少包括医疗器械的级别、风险类别、注册证类别、医疗器械类别、用途、功能、材质、规格、型号、销售厂商、价格、生产批号、生产日期、失效日期等。产品验收涉及的内容及需要记录的事项繁多,对于大型三甲综合性医疗机构,医疗器械的进货查验量非常巨大,如无高效的技术管理手段,将会严重影响医疗器械管理的质量和效率,同时耗费大量人力。
我院最初利用UDI开展验收管理时,验收人员通过扫码枪扫描UDI条码,通过DI可以获取UDI数据库中的静态产品信息,如规定要求的医疗器械名称、注册证信息、医疗器械类别、规格型号、销售厂商、价格等信息;通过PI,可解析获取动态产品信息,如生产批号、序列号、生产日期及失效日期等信息。通过系统内设校验机制,对医疗器械是否符合遴选规定、质量情况、效期情况等进行自动查验,并形成真实、完整、准确的进货查验记录。该方式在原有常规验收的基础上实现了快速扫描电子化验收,并形成了精确到批次甚至序列号的最小粒度的电子化进货查验记录,验收准确性和效率得到大幅提升。但由于验收产品需要逐个扫描,特别是遇到骨科备货产品验收,200~300件的产品通常要花费40~50 min逐一验收核对,而且经常出现实物与送货单不一致的情况,严重影响临床手术效率。后续我院通过六西格玛精益改进,利用UDI打通上游供应链,通过信息的共建共享,上游经营/配送企业在备货环节就逐一扫描产品UDI条码,通过绑定医疗机构的验收校验机制,保证了配送至医疗机构的物资100%符合验收规定;同时校验信息共享至医疗机构平台,验收人员仅需查看实物包装的完整性和抽验实物与系统信息的一致性后即可验收。通过产品查验信息的共享共建,200~300件产品的验收时间从40~50 min降低至5 min以内,再一次大幅提高了耗材验收管理效率。















