阿尔茨海默病(Alzheimer’s Disease,AD)是最常见的痴呆类型,约占总痴呆的 60~80%。全球目前每 3 秒就新增一例痴呆患者,其中每 4 个人当中就有 1 个是中国人。2016 全球失智症报告指出,2015 年全球已有 4680 万的痴呆患者,预计到 2050 年痴呆人数将达到 1.315 亿,给家庭和社会带来了沉重的负担 1。
目前 AD 病因不清,发病机制不明,存在多种假说,包括β-淀粉样蛋白级联假说、 tau 蛋白假说、 神经递质假说、 脂质代谢假说、 免疫炎症假说和线粒体功能障碍等。近年来 AD 药物研发失败居多,AD 尚无有效根治措施,临床确诊后已无法治愈。
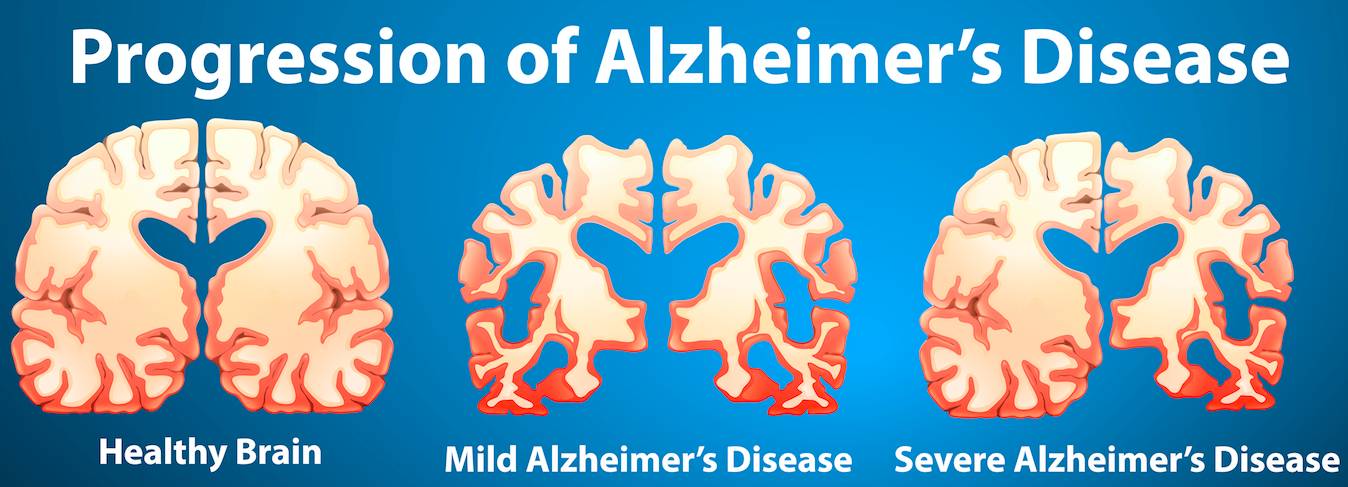 注:正常大脑(左图),轻度阿尔茨海默病(中图),重度阿尔茨海默病(右图)
注:正常大脑(左图),轻度阿尔茨海默病(中图),重度阿尔茨海默病(右图)
2011 年美国国立老化研究院-阿尔茨海默协会(NIA-AA)诊断标准认为:AD 是一个包含无症状期(临床前 AD)、痴呆前期(AD 所致轻度认知损害)与痴呆期(AD 所致痴呆)的三阶段连续疾病谱 2。
在这段漫长的临床前期中,病理生理改变在出现临床症状的 15~20 年前就已经开始。对 AD 干预时间太晚可能是治疗失败的关键原因。因此,早期诊断、及时干预是目前唯一有效延缓疾病进展的措施。
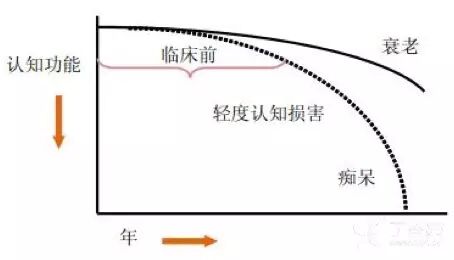
图 1 AD 的三阶段连续疾病谱 2,3
最早的 AD 诊断标准始于 1984 年,只关注临床症状;2007 诊断标准的最大创新就是将生物标志物纳入到核心诊断标准中。最新的 IWG-2 诊断标准即是结合 AD 临床表型和生物标志物异常 4。利用各种生物标志物检测脑内 AD 相关病理改变,使得 AD 的诊断阶段不断提前,为疾病早期识别、及时干预争取了有效时间窗。
目前用于辅助 AD 诊断的生物标志物主要分为两大类:体液标志物和影像标志物 5。
1. 脑脊液标志物
脑脊液(CSF)可直接反映脑组织的病理改变,与 AD 相关的核心脑脊液标记物包括 Aβ42、总 tau 蛋白(t-tau)和磷酸化的 tau 蛋白(p-tau)。
Aβ42 反映了皮层淀粉样蛋白沉积;
t-tau 蛋白反映了神经变性的密度;
这些核心 CSF 标记物有较高的诊断准确性,在 MCI 期的敏感度和特异性可达 85-90%;不仅可作为 AD 痴呆期的诊断标志物,还可用于预测 MCI 的转归。
此外,研究还发现了与 AD 进展相关的新型脑脊液标记物,主要包括 Aβ代谢通路相关分子和突触类标记物。
Aβ代谢通路相关分子,包括 Aβ42/Aβ40、APP 亚型(sAPPα, sAPP β)、BACE1、Aβ寡聚物和总 Aβ等。Aβ寡聚物是 Aβ的毒性聚集形式,最终引起突触功能失调。研究发现 AD 患者 CSF 中 Aβ寡聚物含量升高,但与对照组重叠部分较大。CSF 中可检测到的 Aβ寡聚物较少,利用 ELISA 定量 Aβ寡聚物难度较大,因此限制了其临床使用,需要进一步更敏感的检测手段。
突触类标记物,如树突神经颗粒蛋白,主要参与长时程增强和记忆巩固。CSF 高浓度的神经颗粒蛋白能预测 MCI 向 AD 的转化,并与随访过程中快速记忆损伤相关。突触前蛋白 SNAP25 在疾病前期升高。这些突触类标记物可反映认知症状和治疗反应之间的关系。此外,研究还发现 CSF 中 D-丝氨酸水平增加可能也是早期 AD 诊断的标志物之一。
2. 外周血标记物
血液与 CSF 相比易于获取,侵袭性小,是临床试验的理想标本。目前已有多项研究开始联合应用外周血蛋白、脂质和代谢物等含量来区分 AD 患者和正常人群,如外周血细胞膜的 Aβ42 二聚体含量、可抑制 Aβ纤维化和解聚 Aβ纤维的血浆凝溶胶蛋白(GSN)和 GSN 主要降解酶 MMP3 等。
此外,测量外周血的 CNS 特异性成分(如 tau 蛋白、Aβ含量)也是方法之一,但外周血中这些成分含量较低。目前关于外周成分是否能够真正代表中枢改变,仍存在一定质疑。
3. 尿液标志物
研究发现 AD 早期及 AD 患者尿液中 AD7c-NTP 蛋白含量增加,该蛋白与神经原纤维缠结相关,因此有可能成为 AD 早期诊断的生物标志物之一。
1. 淀粉样蛋白正电子发射断层显像(Amyloid PET)
淀粉样蛋白级联瀑布学说是目前 AD 发病机制的主流学说之一。Amyloid PET 可以提供淀粉样斑块在大脑的分布和含量,与尸检结果一致率高,可作为活体显示 Aβ病理改变的最直接的诊断标志物。
目前临床常用的 Amyloid PET 成像的配体主要有:11C-PIB、florbetapir、florbetaben、flutemetamol 和 AZD4694。这些配体对于皮层淀粉样变性具有较高的准确性 6。
研究发现家族性 AD 患者在无症状期未出现脑萎缩和脑代谢减低时,已出现了脑内淀粉样蛋白沉积,说明 Amyloid PET 有可能是最早出现的生物标志物。然而,脑淀粉样变性是 AD 诊断的必要非充分条件。但目前 PET 由于其价格昂贵、扫描设备等问题应用仍存在一定局限性。
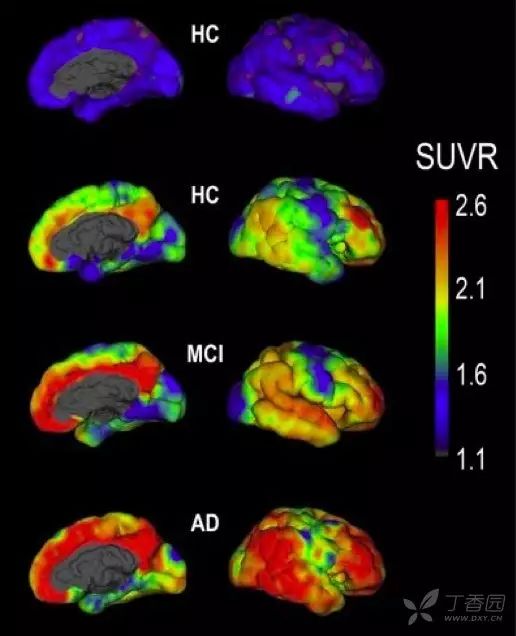
图 2 无症状健康对照组(HC)、MCI 和 AD 患者的 Amyloid PET 成像 6
2.葡萄糖代谢 PET(FDG PET)
FDG PET 用于测量神经元和胶质细胞的葡萄糖摄取情况,被认为是突触功能变化最敏感的指标。AD 患者可出现典型的颞顶区、后扣带回皮质和楔前叶葡萄糖代谢降低,具有 90% 敏感性以识别出 AD 与其他类型痴呆。
也有研究发现,AD 早期颞叶出现高代谢,提示可能为疾病早期代偿表现。携带载脂蛋白 APOEε4 等位基因认知正常受试者也被发现与 AD 相似脑区的代谢异常。因此,作为衡量脑功能改变的指标,FDG PET 对 AD 疾病进展过程中脑功能改变的评估诊断价值更高。
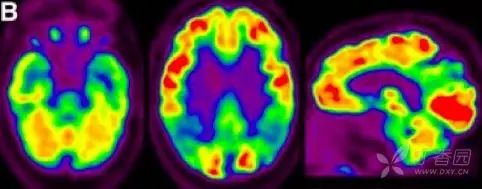
图 3 AD 患者的 18F-FDG PET 成像 7
3. 结构磁共振(sMRI)
sMRI 可测量区域性或全脑体积大小,反映因细胞损伤、轴突退变、突触失调引起的结构萎缩。最早出现并进行性加重的内侧颞叶结构萎缩可能是 AD 早期出现的特征性改变,其中海马萎缩,被认为是 MCI 进展到 AD 痴呆的最佳标志物。
研究还发现,AD 早期人群的皮层灰质、内嗅皮层和海马旁回也存在萎缩。MCI 患者可出现皮质厚度变薄和全脑体积变小,可用于预测 MCI 向 AD 的转化。
2011 年 NIA-AA 诊断标准将 sMRI 作为 AD 神经损伤标记物之一;然而 2014 年最新的 IWG-2 标准认为 sMRI 可能更适合用于测量和监测疾病过程。
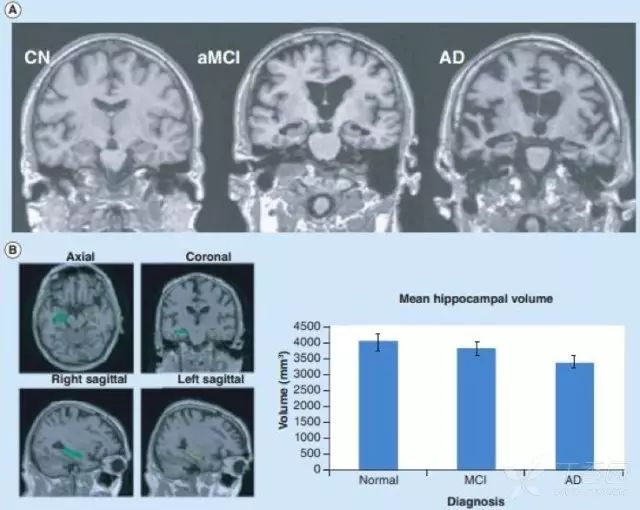
图 4 正常对照组(CN)、aMCI 和 AD 患者的海马体积结构 MRI 成像 3
4. 功能磁共振(fMRI)
大脑接受刺激后,神经细胞活动、局部脑血流、区域的耗氧量发生改变,fMRI 通过血流动力学反应与脑神经细胞活动之间的密切关系,可反映神经元和突触功能异常。fMRI 主要包括静息态和任务态 fMRI 两大类。
研究发现,MCI 和 AD 患者存在静息网络、情节记忆网络、语义记忆网络、视空间记忆网络功能受损。脑内出现淀粉样蛋白沉积但认知功能正常的老年人、APOEε4 基因携带的认知正常老年人,也存在与记忆相关的网络连接性下降,这些研究结果提示脑功能障碍可能在 AD 早期即已出现。
此外,研究还发现记忆相关网络(特别是海马)呈现非线形损害模式,即症状发生前期和轻度损害的 MCI ,影像学可首先表现为海马的高活性,随着病理的进展海马功能将逐渐减弱。
多项研究已证实,AD 疾病进程中功能连接的改变早于明显的灰质体积萎缩。因此,fMRI 有可能成为诊断 AD 的早期生物标志物之一。但是 fMRI 成像产生的间接表现不能直接地反映神经元活性。且目前关于 fMRI 不同研究间的结果变异较大,用于 AD 早期诊断还需更多研究进一步验证。
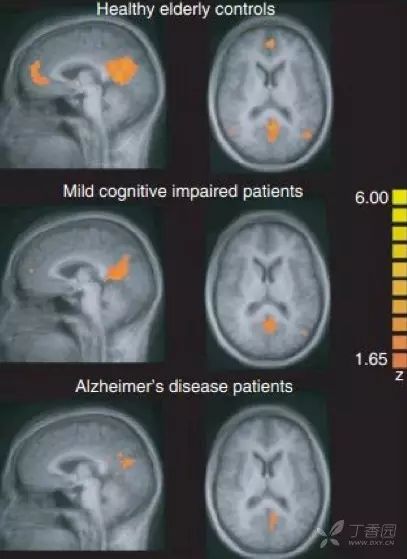
图 5 正常对照组、MCI 和 AD 患者的 fMRI 默认网络功能连接示意图 3
5. 弥散张量成像(DTI)
DTI 利用水分子的弥散各向异性进行成像,可用于脑白质纤维研究。皮层连接的结构基础为各皮层之间白质纤维束,AD 目前被认为是一种进展性的皮层失连接综合症。
DTI 研究发现 MCI 存在诸多白质区域完整性破坏,如额叶、颞顶叶、下额-枕叶束、上纵束、胼胝体和扣带束等。与功能连接类似,AD 疾病进程中结构连接的改变早于明显的灰质体积萎缩。这些结果提示 DTI 有可能作为 AD 早期诊断的生物标志物。
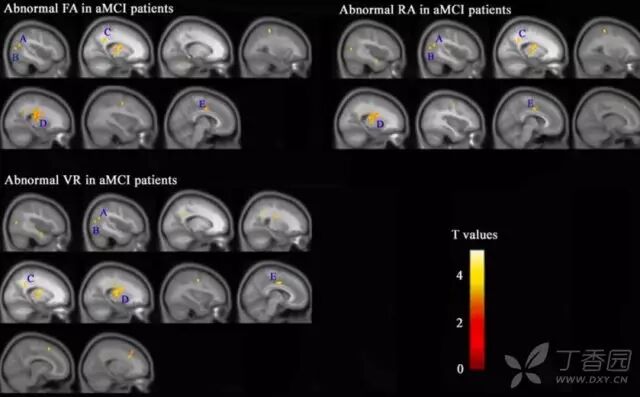
图 6 aMCI 患者的 DTI 成像 8
6. T2 弛豫时间成像
T2 弛豫时间是磁共振固有参数,值取决于组织本身的特点,是组织微结构完整性的间接指标,是脑内各种病理改变的综合反映。研究发现 AD 患者中,存在海马等多脑区 T2 值改变,且动物模型研究发现,在动物疾病早期斑块出现之前多脑区即出现 T2 弛豫时间值改变。
AD 早期存在诸多灰白质脑区脑组织微结构完整性改变,这些微结构完整性改变明显早于体积萎缩。但这些微结构完整性改变并非 AD 特性性改变。T2 弛豫时间成像可能是 AD 早期脑组织微结构完整性的良好生物标记物。
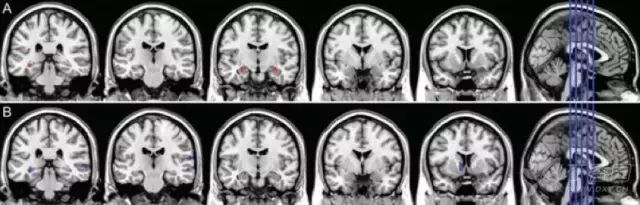
图 7 AD 患者的 T2 弛豫时间成像 9
7. tau 蛋白成像
利用 tau 蛋白的氟化配体进行 tau 蛋白成像目前也是研究热点。tau 蛋白配体聚集与 AD 临床症状符合;且与 Amyloid PET 相比,与基础代谢率减退和脑萎缩更相关。目前 tau 成像主要用于临床药物试验,对于其临床诊断价值仍需进一步证实。
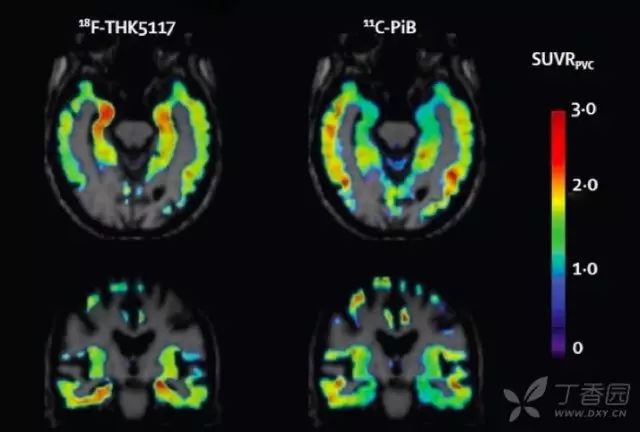
图 8 AD 患者以 18F-THK5117 和11C-PiB 为显影剂的 tau 蛋白和 Aβ成像 10
8. 其他
此外,反映大脑血流量相关信息的单光子发射计算机体层扫描(SPECT)和动脉自旋标记(ASL)MRI,检测神经炎症及神经递质系统(胆碱能系统、多巴胺能系统,五羟色胺能系统组胺能系统和外周苯二氮䓬系统)改变的 PET 成像和磁共振波谱成像(MRS)等,也是 AD 早期诊断标志物的研究热点。
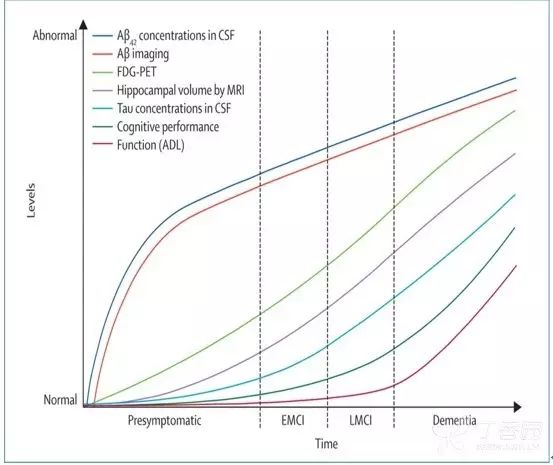
图 9 AD 疾病进展中生物标志物改变 11
综上所述,AD 早期诊断标志物的应用仍处于科研与临床应用的过渡期,还没有哪一种方法能够单独的作为 AD 早期诊断标记物。研究多推荐联合多种生物标记物进行早期诊断,如海马体积、FDG PET、Amyloid PET、CSF Aβ42、t-tau 和 p-tau。AD 诊断标准也在不断更新中。
虽然目前 AD 早期诊断仍存在一定难度,如以上标志物的检测缺乏一定的规范和标准、患者缺乏对 AD 早期的认识和接受度等;但是生物标志物在 AD 早期诊断中意义重大,为疾病早期识别、及时干预争取了有效时间窗,是目前唯一有效延缓 AD 进展的措施。
编辑 | 陈珂楠
投稿及合作 | [email protected]
题图来源| shutterstock

参考文献:
1. World Alzheimer Report 2016
2. Sperling, R. A. et al. Toward defining the preclinical stages of Alzheimer's disease: recommendations from the National Institute on Aging-Alzheimer's Association workgroups on diagnostic guidelines for Alzheimer's disease. Alzheimer's & dementia : the journal of the Alzheimer's Association 7, 280-292, doi:10.1016/j.jalz.2011.03.003 (2011).
3. Kehoe, E. G., McNulty, J. P., Mullins, P. G. & Bokde, A. L. Advances in MRI biomarkers for the diagnosis of Alzheimer's disease. Biomarkers in medicine 8, 1151-1169, doi:10.2217/bmm.14.42 (2014).
4. Dubois, B. et al. Advancing research diagnostic criteria for Alzheimer's disease: the IWG-2 criteria. Lancet neurology 13, 614-629, doi:10.1016/S1474-4422(14)70090-0 (2014).
5. Scheltens, P. et al. Alzheimer's disease. Lancet, doi:10.1016/S0140-6736(15)01124-1 (2016).
6. Villemagne, V. L. & Chetelat, G. Neuroimaging biomarkers in Alzheimer's disease and other dementias. Ageing Res Rev, doi:10.1016/j.arr.2016.01.004 (2016).
7. Nasrallah, I. M. & Wolk, D. A. Multimodality imaging of Alzheimer disease and other neurodegenerative dementias. J Nucl Med 55, 2003-2011, doi:10.2967/jnumed.114.141416 (2014).
8. Bai, F. et al. Abnormal white matter independent of hippocampal atrophy in amnestic type mild cognitive impairment. Neurosci Lett 462, 147-151, doi:10.1016/j.neulet.2009.07.009 (2009).
9. Su, L. et al. Cortical and Subcortical Changes in Alzheimer's Disease: A Longitudinal and Quantitative MRI Study. Curr Alzheimer Res 13, 534-544 (2016).
10. Villemagne, V. L., Fodero-Tavoletti, M. T., Masters, C. L. & Rowe, C. C. Tau imaging: early progress and future directions. Lancet neurology 14, 114-124, doi:10.1016/S1474-4422(14)70252-2 (2015).
11. Petersen, R. C. Alzheimer's disease: progress in prediction. Lancet neurology 9, 4-5, doi:10.1016/S1474-4422(09)70330-8 (2010).














