-
电脑模拟发现tCoa-NGR能识别凝血酶原
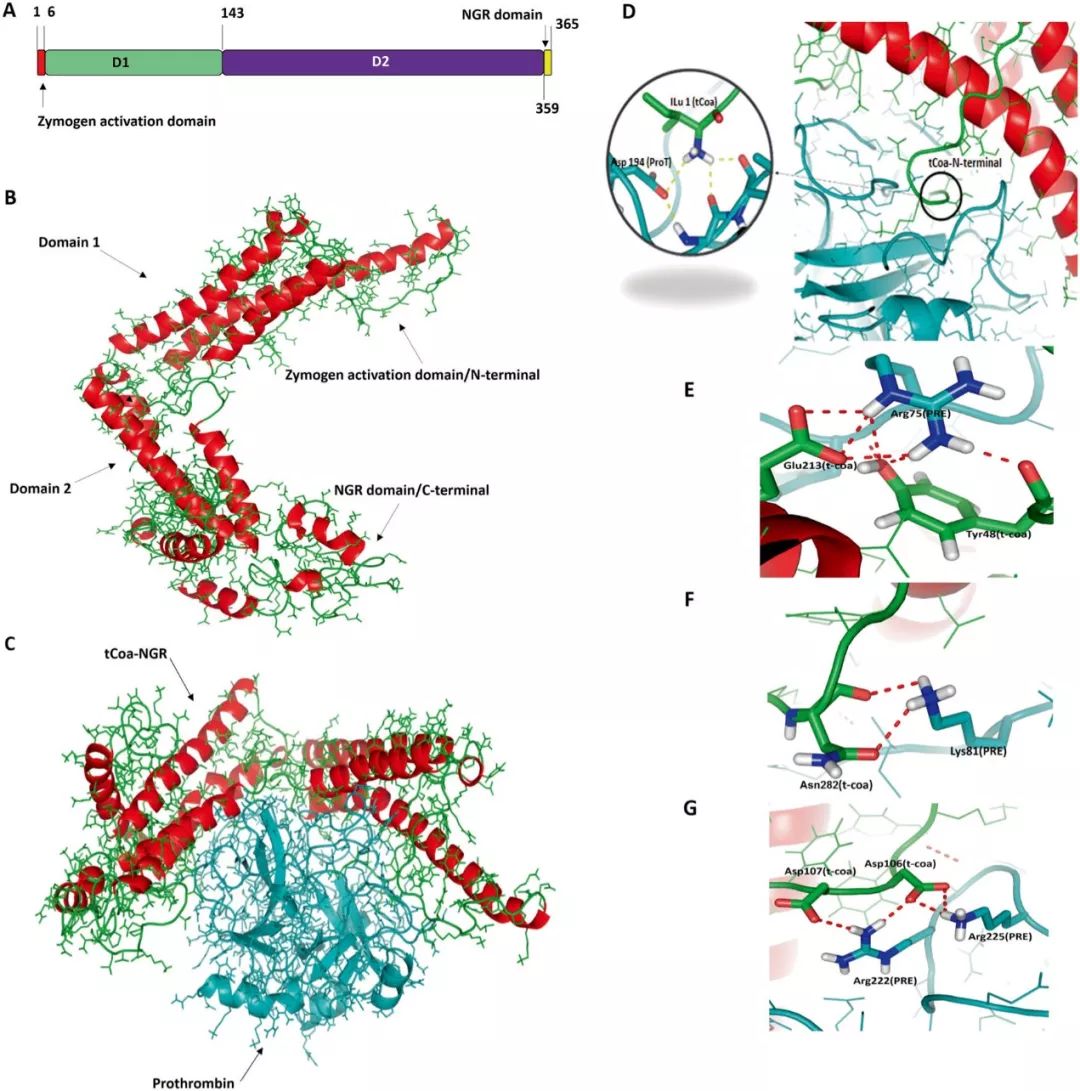
在开展实验前,研究工作者分析了tCoa-NGR融合蛋白的构象以及其与凝血酶原的相互作用(如图2),图2a展示tCoa-NGR的结构,图2b展示的是tCoa-NGR蛋白的三维构象,由两个结构域,C端识别血管内皮细胞表面抗原CD13和
α
v
β
3
,N端负责识别凝血酶原并激活,图2c展示tCoa-NGR-凝血酶原的复合体构象,凝血酶原落入tCoa-NGR口袋结构内,图2d展示了凝血酶原的Arg
75
与tCoa-NGR的Glu
213
和 Tyr
48
的相互作用,图2e展示凝血酶原的Lys
81
和tCoa-NGR的Asn
282
的相互作用,图2f展示了整体凝血酶原与tCoa-NGR的相互作用。
图2 tCoa-NGR蛋白分子动态研究
通过上述分析,研究工作者初步确定了tCoa-NGR和凝血酶原的相互作用。
-
tCoa-NGR能激活凝血酶原诱导凝血并靶向结合内皮细胞受体
研究工作者通过分子克隆分别纯化了tCoa和tCoa-NGR蛋白,首先通过凝血实验检测其凝固酶活性,与tCoa相比,tCoa-NGR与凝血酶原结合在更短时间内导致凝固(如图3a),接着通过ELISA评估His标记的tCoa-NGR对特异表达CD13和
α
v
β
3
的HUVECs的结合,通过竞争结合实验发现,加入非His标记的tCoa-NGR蛋白后,其竞争结合CD13和
α
v
β
3
,显著降低了His标记的tCoa-NGR结合的HUVECs(如图3b)。进一步研究发现,tCoa-NGR与内皮细胞的结合呈现剂量依赖性,且在0.8 nM结合效率最高(如图3c)。此外,研究工作者利用FITC分别标记tCoa和tCoa-NGR,通过FACS评估了tCoa-NGR与内皮细胞受体结合能力,如图3d所示,M1 marker确定没有结合蛋白的细胞,M2 marker确定结合蛋白的细胞,其中peak1代表tCoa,peak2代表tCoa-NGR,由此可知FITC标记tCoa-NGR与内皮细胞的结合效率约60%,而tCoa不结合内皮细胞。
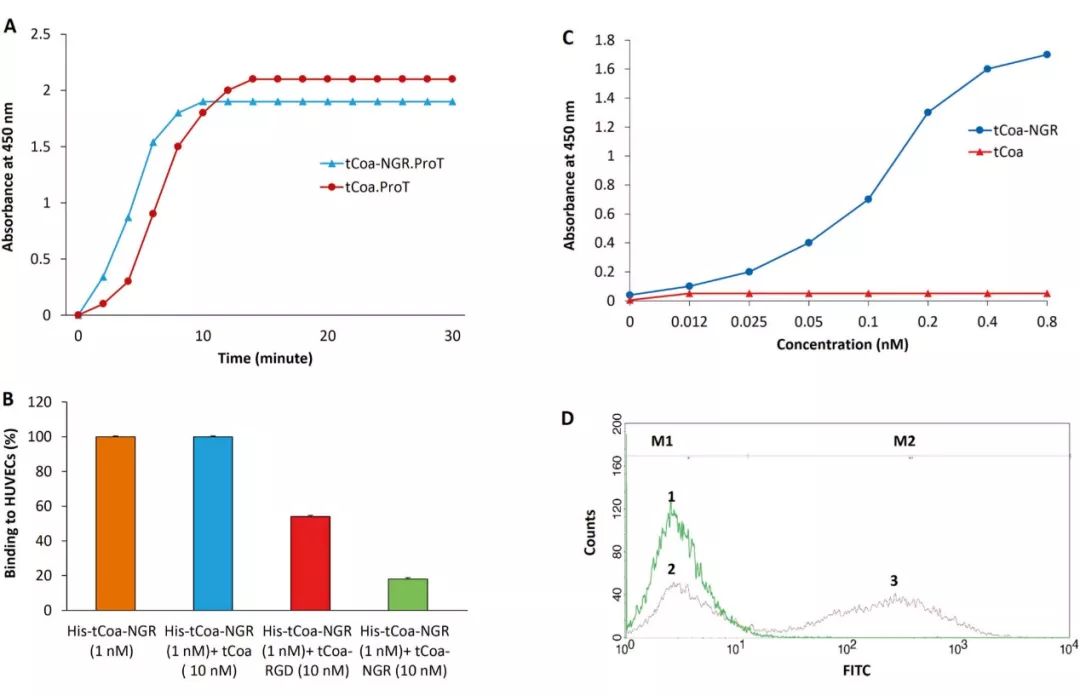
图3 体外评估tCoa-NGR的凝固酶活性和靶向结合能力
通过上述实验,研究工作者证明了tCoa-NGR具有凝固酶活性,而且靶向识别内皮细胞。
-
tCoa-NGR蛋白在肿瘤动物模型中富集于肿瘤部位并通过诱导血栓抑制肿瘤生长
为进一步研究tCoa-NGR的作用,研究工作者利用高表达CD13和
α
v
β
3
的PC3细胞系构建肿瘤动物模型,分别通过尾静脉注射20μg的荧光标记的tCoa-NGR蛋白、tCoa蛋白,同时注射生理盐水作为对照组,结果如图4所示,对照组和注射tCoa蛋白实验组的裸鼠中未发现特异性富集,但注射tCoa-NGR蛋白实验组中,肿瘤部位FITC荧光强度很强,提示tCoa-NGR蛋白在体靶向富集于肿瘤部位。
在此基础上,研究工作者在裸鼠皮下分别注射4T1和PC3癌细胞的构建了两种肿瘤动物模型,三天连续给予10μg的tCoa-NGR蛋白或者tCoa蛋白处理,同时生理盐水作为对照组,记录7天内肿瘤生长情况,结果如图5。图5a展示在PC3肿瘤生长第七天,与tCoa蛋白处理相比,tCoa-NGR蛋白处理组肉眼可见肿瘤出血,且体积小很多,这提示tCoa-NGR通过诱导血栓形成抑制肿瘤生长,与此一致的是,在4T1和PC3肿瘤动物模型中,在治疗3天后,与生理盐水组和tCoa蛋白处理组相比,tCoa-NGR显著抑制肿瘤生长(如图5b),HE染色可知在4T1和PC3肿瘤中,tCoa-NGR蛋白处理组存在明显的血管栓塞,而生理盐水组和tCoa蛋白处理组中的血管结构正常,Masson三色法染色法进一步确定栓塞存在新生血管内(如图5c)。
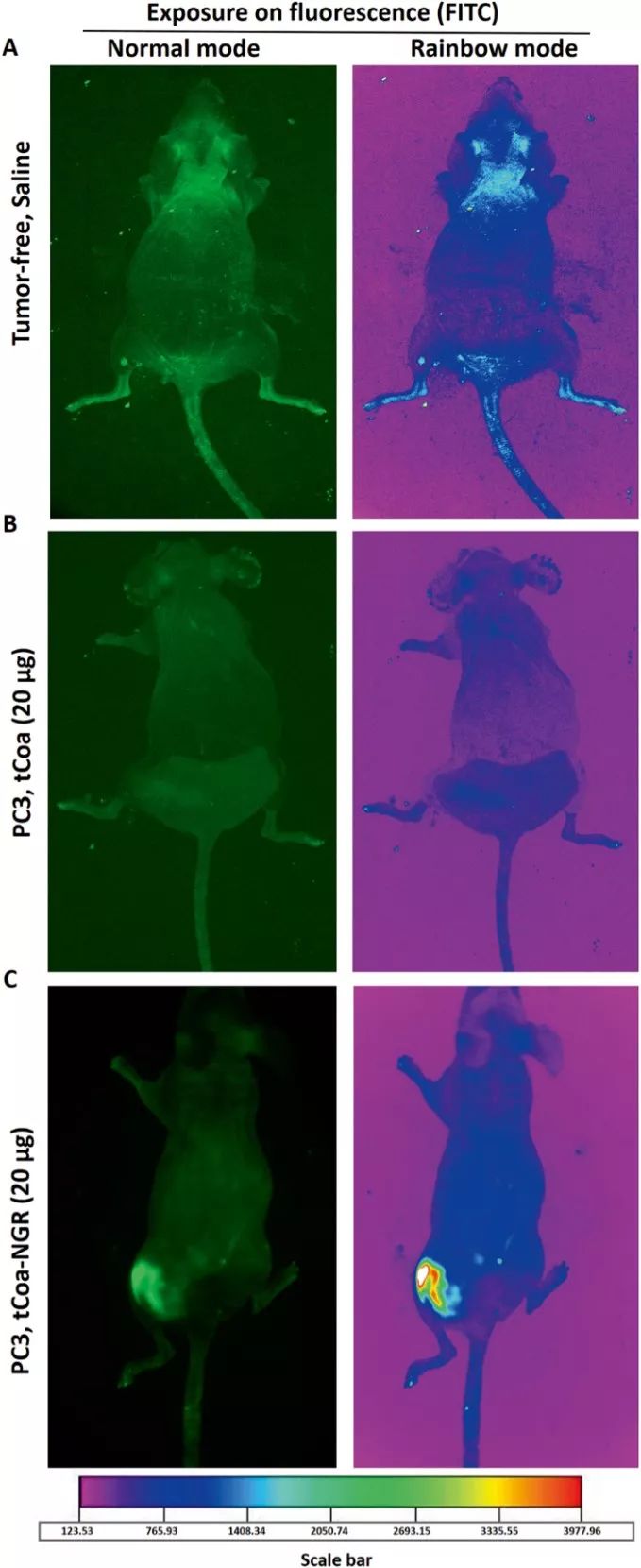
图4 在体追踪荧光标记的tCoa-NGR蛋白
为进一步探索tCoa-NGR蛋白抗肿瘤的分子机制,研究工作者通过免疫组化检测了PC3肿瘤中CC3、Ki67和CD13的表达水平,结果如图6,在对照组和tCoa-NGR蛋白处理组中,CD13表达都很高,提示在PC3肿瘤中存在较多新生血管;与对照组相比,tCoa-NGR蛋白处理组中CC3水平增加,Ki67水平降低,提示tCoa-NGR蛋白处理肿瘤后,能诱导细胞凋亡并抑制细胞增殖。
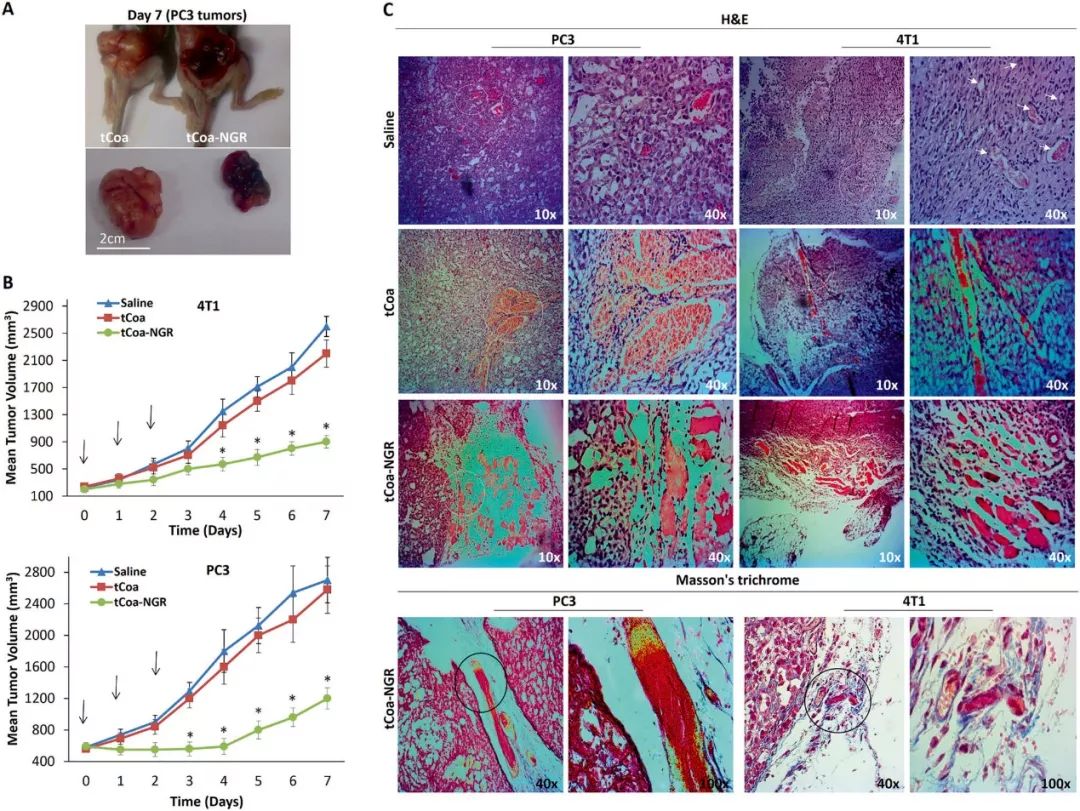
图5 在体评估tCoa-NGR蛋白治疗潜能
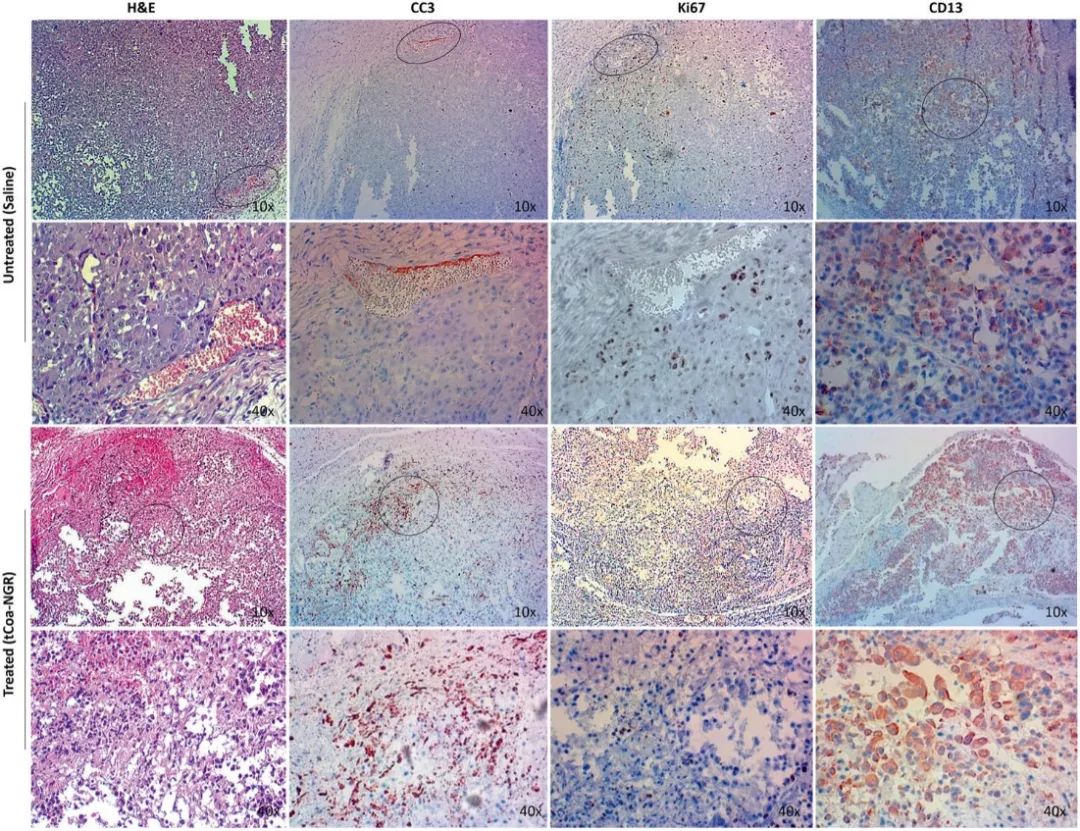
图6 PC3肿瘤组织中CD13、Ki67和CC3表达检测
-
tCoa-NGR蛋白在体具有良好的耐受性且副作用较小
为评估tCoa-NGR蛋白在体内的药物毒性/耐受性,研究工作者尾静脉单次注射100μg的tCoa-NGR蛋白,生理盐水组为对照组,通过肉眼观察异常出血、尾巴糜烂、意外死亡等症状,同时集合血清学检测和显微观察(HE染色),如图7a,全面评估tCoa-NGR蛋白的副作用。在注射一周后,所有小鼠都存活,没有明显的副作用。血清学检测ALT、AST、ALP和肌酐在对照组和tCoa-NGR蛋白处理组中基本无差异(如图7b和7c),但是尿素在tCoa-NGR蛋白处理后上调约1.5倍(如图7c),提示tCoa-NGR可能具有一定的肾脏毒性。HE染色显示,与正常组织相比,低剂量(10μg)和高剂量(100μg)的tCoa-NGR蛋白处理组小鼠的脾脏、脑、肺、肾脏、心脏和肝脏中没有明显的栓塞或者组织坏死。
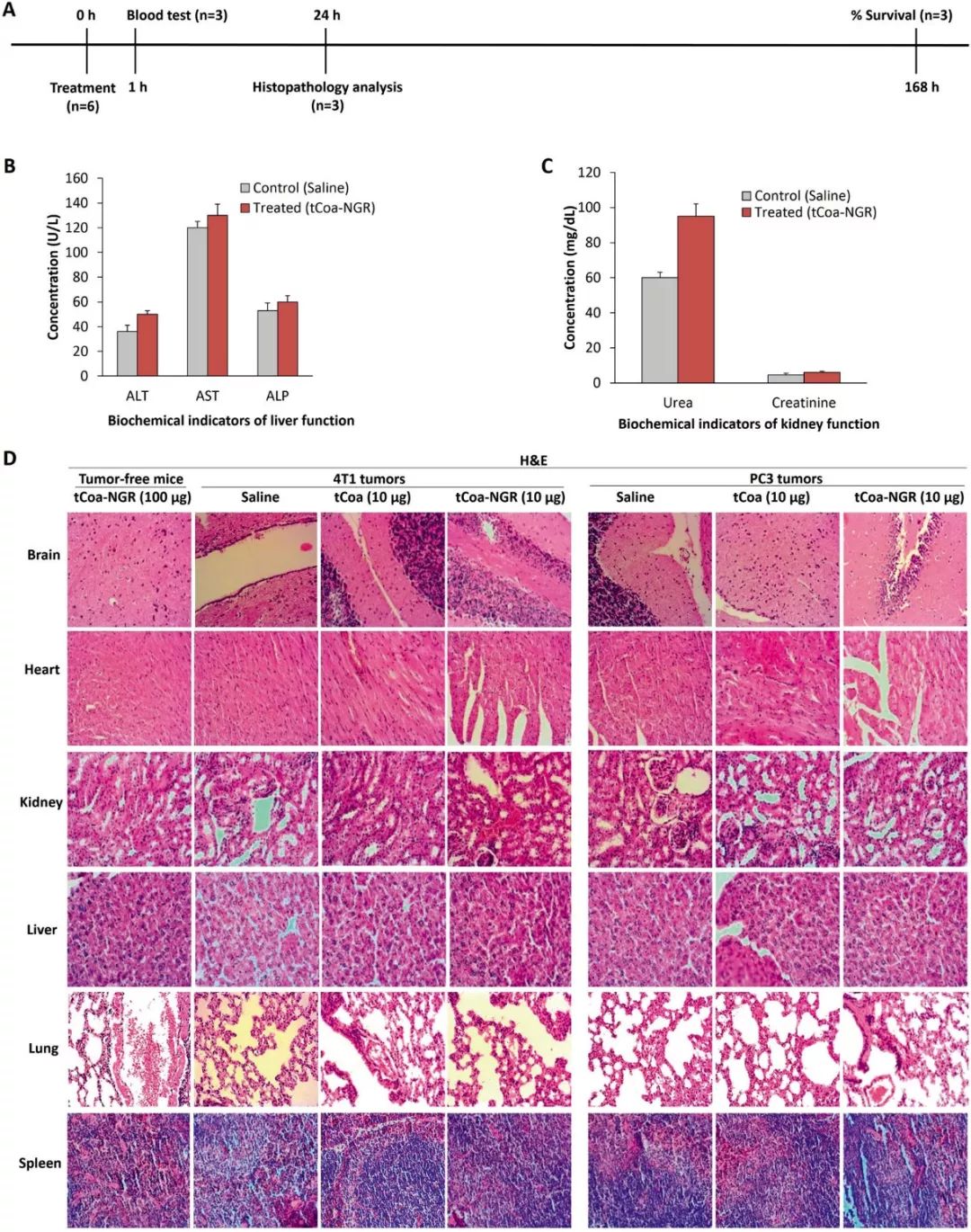
图7 小鼠体内tCoa-NGR的毒性及药物耐受性研究













