一些新药的临床开发,比如抗肿瘤药或抗HIV药,企业往往需要花费很长的时间才能到达临床终点。为满足临床用药需求,FDA在1992年推出了“加速批准”通道,主要针对严重的危及生命的疾病,可基于合理的能够预测临床效益的“替代终点”(实验室测量指标、物理特征等)来加速批准(accelerated approval)某个新药上市。
加速批准是一种“先批准后验证”的药物监管制度,如果上市后验证了临床疗效,则维持原先的批准,反之则撤销批准或修改药物标签。目前美国上市的新药中借助“加速批准”上市的药品占大约10%。加速批准的新药必须在标签上注明“药物临床获益尚未确证,验证性临床试验正在进行中”。
加速批准带来了一些积极的早期临床获益,当然也有一些例外,如FDA曾基于PFS的替代终点批准Avastin(贝伐珠单抗)用于治疗乳腺癌,但随后的临床研究显示,贝伐珠单抗并没有OS获益且出现了一些安全性问题,在经过1年的听证与争论后,贝伐珠单抗的乳腺癌适应症被取消。
尽管临床获益不确定,但加速批准的药物仍是FDA认可并支持上市的药物,保险公司必须决定是否以及如何支付这些药品。随着药品价格的飞涨,医保支付的问题日益突出。
部分加速批准的新药及定价
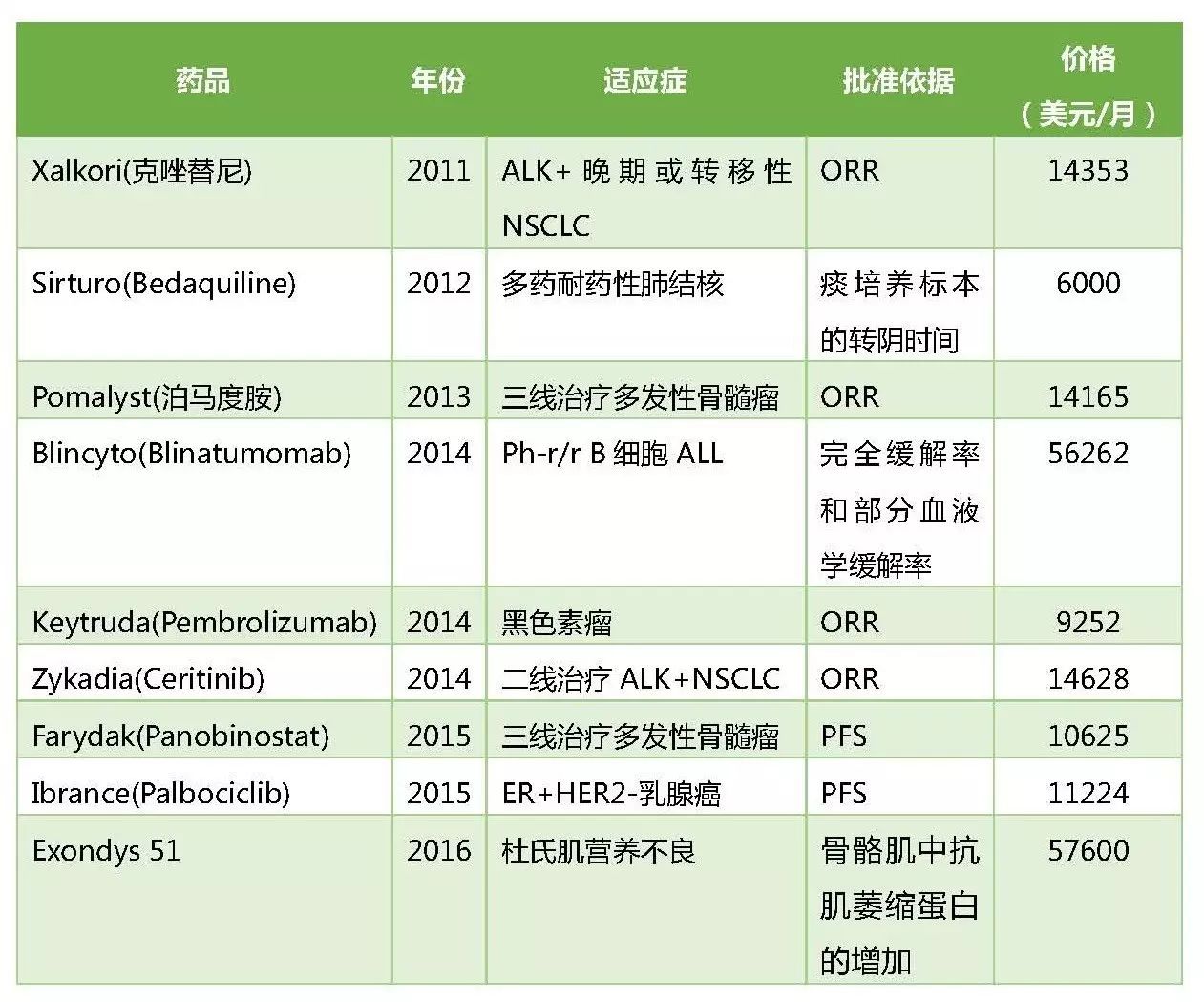
上图是2011年来获得FDA加速批准的部分药物,其中Exondys 51 (eteplirsen) 在2016年9月被FDA加速批准用于治疗杜氏肌营养不良症(DMD),批准依据的替代终点是患者骨骼肌中抗肌萎缩蛋白的增加,而这个替代终点能否反映临床获益一直饱受争议。
Eteplirsen上市后的定价为30万美元/年,随着患者体重增加,费用有可能更高。尽管患者对这种新疗法期待甚高,但在高药价面前无法企及。美国一家全国性的保险公司Anthem拒绝支付Eteplirsen,称其为“实验性疗法”。另外一家保险公司Humana只支付门诊患者,并设定了基于临床反应的停药标准。与私人保险相比,医疗补助(Medicaid)和医疗保险(Medicare)在新药覆盖上有更严格的操作规则。
医疗补助(Medicaid)有一个法定的要求,对于未到65岁退休年龄的广大贫困人口,几乎覆盖所有FDA批准的药物。医疗补助项目可以提起事先授权需求,以确保处方药是临床必需的,但是限制某些已批准药物应用是困难的。一些医疗补助项目试图限制昂贵的直接抗病毒类丙肝药物用于高危风险病人,但却被起诉涉嫌不适当的事先授权。
医疗保险(Medicare)要求覆盖“合理和必要”的药物,Medicare主要包括4部分,Part A支付住院费用或出院后专业护理所需费用,Part B支付医师服务费及大部份Part A不承保的医疗费和医疗用品,Part C为差额保险,PartD为处方药物计划。补贴特定处方药品的Part D在决定哪些药物入选处方集时具有一定的灵活性,其中主要的是6种“protected classes”药物,该计划几乎涵盖所有FDA批准的药物,肿瘤药物属于“protected classes”中的一种,而肿瘤药物又是加速批准的主力军。
因此,当药物的年均花费较高的时候,私人保险可能会以“花费昂贵、临床有效性未获证实”为由而拒绝支付某些加速批准的新药,违背了“加速批准”制度让患者尽早获得潜在重要治疗手段的的初衷。这样以来,美国国家医保资金就会被迫支付这些药物。对于国家医疗保险来说,加速批准不仅是新产品进入市场的途径,更是承担了为未经证实的疗法支付高昂治疗成本的风险。
对于这些挑战,Walid F. Gellad和 Aaron S. Kesselheim两位科学家近日在《新英格兰医学杂志》上发文提出了一些政策性建议,主要包括以下3个方面:
在验证性临床完成之前,制药企业需要为加速批准的药品提供额外的价格优惠。获得加速批准的药物自有其临床价值,但纳税人支付的价格应是根据现有临床数据制定。不过这种强制的折扣可能会导致标价更高的问题。因此政府应该只报销该药的生产成本以及经双方协商的固定利润直至其验证性临床完成,这样一方面可以惠及患者,另外一方面可激励企业尽快完成临床试验
FDA需要进行更多的工作,以确保药物在接受加速批准后及时进行验证性临床,让新药的临床效果不确定期尽可能缩短。
所有通过加速批准上市的,年花费超过10万美元/年(或者其他经过协商认同的门槛)的药物,在加速批准上市1~2年内应进行药物经济学分析。分析可以由医疗保险和医疗补助服务中心经济学家或者政府审计局进行。如果一个药物的高昂定价对国家医保资金的稳定造成了威胁,那么这个新药加速批准的价值就会丧失。
两位科学家认为,在国家医保资源有限的情况下,加速批准的昂贵药物会导致其他已得到临床证据支持的可用药品资源减少,因此必须对加速批准程序进行优化,以确保其继续造福社会。
参考资料:Accelerated Approval and Expensive Drugs — A Challenging Combination
相关阅读:「优先审评」下的药审速度 ——最快审批仅需17天












