

摘要
:
目前仿制药在我国医药市场占据很大规模,口服固体制剂一致性评价得到的关注最多。其中药品的体内外相关性一直是研究者关注的重点及难点,如何通过控制再评价品种与参比制剂体外某些特性(如溶出、制剂学因素等)的相似,达到两者体内生物等效,对于缩短药品的一致性评价进度,降低研究成本具有重大的意义。就目前口服固体制剂一致性评价体内外相关性的相关研究进展进行综述,以期为开展口服固体制剂一致性评价研究工作提供参考。
中国是仿制药生产大国,总体仿制药市场规模达到
5 000
亿元,占总药品消费市场的约
40%
,然而在现有的
18.9
万个药品批文中,其中
95%
是仿制药批文,制药企业绝大部分以仿制药为主
[
1
]
。自
2016
年国家药品监督管理总局发布关于开展仿制药质量一致性评价工作的通知,正式启动化学药品一致性评价工作以来,中国仿制药一致性评价如火如荼地开展起来,截至
2020
年
9
月
11
日,通过一致性评价的药仿制药的受理号共有
567
个,据不完全统计有超过上千个品规通过一致性评价
[
2
]
。在仿制药一致性评价工作众多的研究要点(如处方、工艺、体内外相关)中,体内外相关性研究是药品一致性评价研究的重点与难点。良好的体内外相关性(
in vitro-in vivo
correlation
,
IVIVC
)可以使研究者通过控制再评价品种与参比制剂体外的某些特性(如溶出曲线、粒径、晶型)的相似,达到再评价药品与参比制剂生物等效的目的。
当前一致性评价受理的仿制药品种以口服固体制剂和注射制剂为主体
[
2
]
。对于口服固体制剂而言,其溶出行为往往被作为评价其与参比制剂的质量是否一致的主要指标,但是在现实研究中,研究者发现对于一些品种其存在有溶出程度低、溶出过快、参比制剂批间溶出行为差异较大等情况,导致其很难用溶出行为作为其与参比制剂体内行为相似的体外指标。本文旨在对于那些不能以溶出相似因子作体内外相关性建立为指标的药物提供新的研究思路,比如通过研究参比制剂晶型或粒径,参比制剂所用辅料,建立计算机生物模拟系统等。建立药品的体内外相关性评价体系,有助于快速发现影响药品生物等效性的关键质量属性,有助于加快药物的研发进度和节约研究成本。
1
基于溶出相似因子(
ƒ
2
)的体内外相关性研究方法
口服固体制剂经口服后,其所含活性成分必须释放并在胃肠道中溶出后方能被胃肠道吸收,从而发挥其药效
[
3
]
。对大部分药物而言,体外的溶出行为与体内的药物吸收密切相关,所以目前控制再评价品种与参比制剂溶出行为相似是目前主流的研究方法。目前,世界主流医药市场所在国家先后建立了体外溶出指导原则,通过查阅各国药典和相关文献,对各国药典溶出研究中的溶出装置和溶出曲线的总结见表
1
[
4-9
]
。

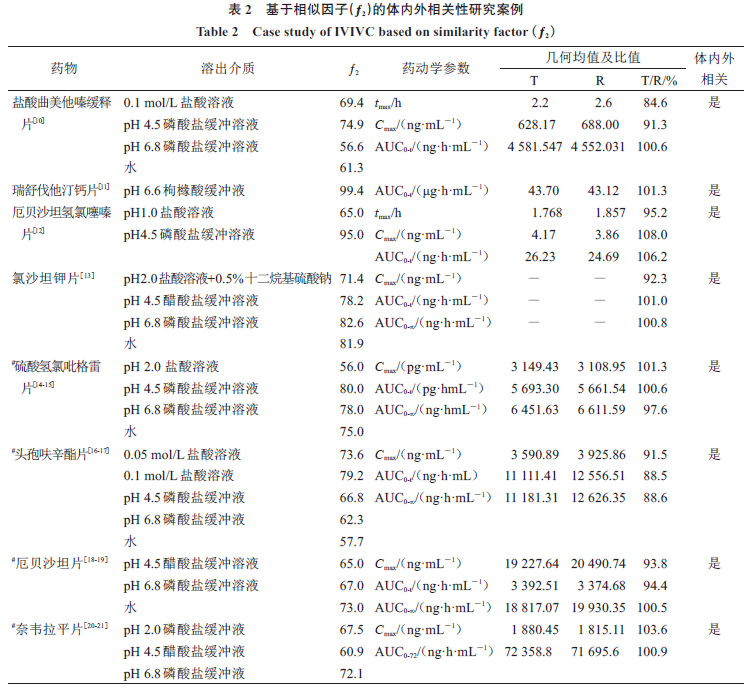
在溶出曲线相似性研究方法中,溶出相似因子(
ƒ
2
)是目前口服固体制剂体内外相关性的首选方法。目前人们常采用的传统的药典记载的溶出度评价方法为非模型依赖法中的相似因子(
ƒ
2
)法。一般情况下
ƒ
2
≥
50
,可认为两条曲线具有相似性。以该方法判断再评价品种与参比制剂的溶出行为相似性,与后续的生物等效性具有良好的体内外相关性。基于相似因子(
ƒ
2
)的体内外相关性研究案例见表
2
,其中
“#”
标记的药物由于数据资源匮乏其相似因子
ƒ
2
与药动学参数数据来源于不同的相关文献报道,
T
为自制制剂,
R
为参比制剂。
 2
其他体内外一致性研究方法
2
其他体内外一致性研究方法
基于溶出相似因子的体内外相关性研究方法仅可适用于可以计算相似因子的产品,对于无法计算相似因子的品种,如溶出度过低(溶出终点只有不到
10%
)或溶出速率特快(
15min
甚至
5 min
内溶出度可达
85%
以上,该研究方法并不适用。此外根据药物的生物药剂学分类系统(
biopharmaceuticsclassification system
,
BCS
)可将药物分为以下
4
类
[
22-23
]
:
Ⅰ
类药物,高溶解度,高渗透性,如对乙酰氨基酚、美托洛尔等;
Ⅱ
类药物,低溶解度,高渗透性,如阿托伐他汀、伊曲康唑等;
Ⅲ
类药物,高溶解度,低渗透性,如二甲双胍,阿替洛尔等;
Ⅳ
类药物,低溶解度,低渗透性,如紫杉醇、黏菌素等。药物呈现的吸收限制过程亦不同,对于
BCS Ⅰ
类和
Ⅱ
类来说,溶出是限制其吸收的因素,
BCS Ⅲ
类品种药物渗透性影响其吸收,而
BCS Ⅳ
类品种,溶出和渗透性都将限定药物的吸收。对于吸收限制过程为溶出的品种而言,可以从溶出行为的角度入手进行体内外的一致性评价;但对于吸收限制过程为膜渗透性的产品而言,显然需要更多的其他体内外研究方法。
2.1
控制原料药的粒径
影响药物的溶出因素有很多,有些药物便可通过控制粒径的大小使溶出行为与原研制剂一致,以达到生物等效。
Henwood
等
[
24
]
研究利福平原料药的溶解度和溶出性能时,发现不同厂家间原料药之间的主要差异是非晶型含量,于是增加无定形量,随着无定形量加入反而显著降低了粉体在水中的溶解速率,同一厂家利福平的溶出批间差异也大,其可能与无定型药物占比有关,但无定型多,虽溶解度会增大,但并不一定会提高溶出速率,其可能与其它因素(如粒径)有关,或许可以通过控制粒径来控制药物的体外溶出。
王燕等
[
25
]
在研究替格瑞洛原料药粒径对其片剂体外溶出行为的影响,发现原料药经粉碎后可显著提高替格瑞洛片的体外溶出度且药粒径越小,所制片剂溶出行为越接近原研片,经研究数据和结果建议制备替格瑞洛片时原料药的粒径分布应控制在
≤
20μm
,以获得与原研片生物等效的制剂。
2.2
模拟生物介质或模拟生物系统
目前药物溶出研究所用的溶出介质大多是药典指导中的常规溶解介质,有些药物在这些常规介质中溶出速率很慢,难以通过计算
ƒ
2
值来判断溶出曲线的相似性。药物吸收是胃肠道中一个复杂的过程,受到胃肠道(
GI
)生理学相关的诸多因素的影响
[
22
]
,当药物溶出速率很慢时,可采用模拟生物介质或模拟生物系统来研究药物的溶出行为。
吴晓雯等
[
26
]
在盐酸西那卡塞片体外溶出行为研究中,在考察盐酸西那卡塞片在不同介质(
pH
值分别为
1.2
、
2.0
、
4.5
、
6.8
的溶出介质和水)中的体外溶出行为,发现
IVIVC
均较差。为了更真实地模拟药品在胃肠道中释放的情况,采用人工胃肠液[人工胃液(
SGF
)、饱腹人工肠液(
FeSSIF
)、空腹人工肠液(
FaSSIF
)]进行该制剂的体外溶出行为研究,结果发现在
FeSSIF
中,该制剂体外溶出行为与其体内药动学过程存在良好的相关性,故可采用体外溶出试验预测该制剂的体内药物释放和吸收情况。
Tsume
等
[
27
]
创建了一种新的体外溶出系统
——
微型胃肠模拟器(
mGIS
),用于预测弱碱性药物达沙替尼的体内溶出现象,达沙替尼的最大溶出度
USP
溶出装置
Ⅱ
在
pH 6.5
人工肠液(
SIF
)中小于
1%
,而具有
mGIS
(
pH 1.2SGF/pH6.5 SIF
)的装置几乎达到
100%
,当胃
pH
值升高时,达沙替尼与
mGIS
的溶出度降至低于
10%
,结合计算机模拟的实验结果表明,
mGIS
预测了由于胃
pH
升高导致的体内溶出,预计该
mGIS
法将显著推进体内药物溶出的预测。
2.3
计算机模拟技术
当药物溶出条件满足不了采用非模型依赖法中
ƒ
2
法比较溶出曲线相似性的要求时,可通过模型依赖法计算机模拟软件进行药物生物等效性研究。计算机模拟技术有可操作性强、成本低、试验周期短的优点,可节省大量的动物和人体试验
[
28
]
。近年来计算机模拟技术发展迅速,生理药动学(
physio-logicallybased pharmacokinetics
,
PBPK
)建模已成为最可靠的药代动力学建模工具之一,目前运用的模型有
GastroPlus
TM
软件建立的先进房室吸收和转运模型(
advanced compartmental absorption and transit model
,
ACAT
),
K-Sim
®
软件建立的高级溶解、吸收和代谢模型(
advanced dissolution
,
absorption and metabolism model
,
ADAM
),
STELLA
®
软件建模等,计算机模拟软件操作性强、成本低、试验周期短的优点,可节省大量的动物和人体试验
[
29
]
。
潘瑞雪等
[
30
]
采用
Gastro Plus
TM
软件对国产阿莫西林胶囊进行单次模拟实验和群体模拟实验,结果显示无论是以
C
max
还是
AUC
为指标,当阿莫西林胶囊的释放速率为
t
85%
=45 min
时,其均值的
90%
置信区间完全在参比均值的
80%
~
125%
内,可认为其与参比制剂具有生物等效性。
张凤妹等
[
31
]
用了《中国药典》中常用的
4
种溶出溶出介质(水、
pH 1.2
、
pH 4.5
和
pH 6.8
的溶出介质)研究国内
3
家企业生产的阿那曲唑的溶出行为,通过
GastroPlus
TM
软件将原研阿那曲唑片体外各
pH
值介质中的溶出曲线导入
IVIVC Plus
模块,创建相关性模型。发现
4
种溶出介质中的溶出曲线与软件模拟的体内行为非常相似,吻合度较高,说明国内
3
家阿那曲唑都有良好的体内外相关性。
2.4
模拟生物介质与计算机模拟技术联用
在进行药物的体外溶出行为研究时,当发现用
1
种固定方法或模型无效时,应该怎么将研究继续下去?例如格列美脲,在低
pH
值(
pH 1.2
缓冲液)溶解度极小,
1.5 h
后溶出度仍小于
10%
,在胃内的溶出几乎可以忽略不计,在高
pH
值(如
pH 7.4
、
7.8
溶出介质)条件下或加入大量表面活性剂的情况下,各制剂
15 min
内格列美脲的溶出度都能达到
85%
,也很难区分制剂间的差异,且这些条件与体内生理条件完全不同,不具有预测药物体内行为的参考价值,也难得出体内外是否相关的结果
[
32-33
]
。
药物释放是一个复杂的过程,用一种固定的模型或方法往往很难对所有的溶出数据进行很好的拟合或比较,基于各种模型或方法的原理、特点的不同,常需要结合具体情况进行选用,才能更好地解决药物体内外相关性的问题
[
34
]
。有人在对格列美脲片的体外溶出行为研究时,将格列美脲放入水、不同
pH
值(
pH
值分别为
1.2
、
5.0
、
6.0
、
6.8
、
7.4
、
7.8
)的磷酸盐缓冲液、
FaSSIF
和
FeSSIF
溶液介质中得出对应的溶出曲线,采用软件
Gastro Plus
TM
中的
ACAT
模型进行建模,发现生理性溶出介质
FaSSIF
中的体外溶出与体内吸收之间呈现出较高相关性
[
35
]
。
3
影响药物体内外相关性的因素
在开展仿制药一致性评价时,找出制剂中的关键质量属性(
CQAs
)对药品的质量、安全、有效性起关键作用。可以通过对原研药处方进行研究推断出一些关键质量属性。原料药的盐基形式晶型、粒径和辅料都很有可能直接影响药物的溶出和生物利用度,可以通过这些关键质量属性控制药物的溶出和提高药物生物利用度。
3.1
盐基形式
一种药物的活性成分(
API
)可以以多种盐基形式存在,不同的盐基形式可能使药物有着不同生物学性质,这些对药物产生显著的安全性和毒性影响。
API
成盐的共轭阳
/
阴离子可能导致
API
的毒性,例如马来酸盐的马来酸阴离子,马来酸普拉多林表现出肾毒性,并能引起狗的肾小管病变
[
35
]
。同离子效应对
API
成盐的影响,像双氯芬酸的锌粉剂相比钠盐制剂能够更快的被吸收并发挥疗效
[
36
]
。
多晶型常被用作确定盐基的关键因素,在药物的制备过程中,原料药的晶型差异可能影响制剂的溶解度和溶出行为,进而影响药物的生物利用度。如
Deng
等
[
37
]
通过考察体外溶出情况来区分
3
种晶体形式的卡马西平(
BCS II
类药物)研究中发现辛醇相中的不同晶型的卡马西平的溶解度不同,卡马西平的溶解度由大到小依次为:晶型
III
>晶型
I
>二水合物晶型。张锦琳等
[
38
]
在研究国产利福平胶囊与参比制剂体外溶出一致性时,发现所考察的几种国产利福平与参比制剂的溶出曲线均不相似,再进一步研究中发现国产利福平制剂使用的原料与国外原研制剂使用的原料来自于不同晶型。
3.2
粒径
原料药的粒径不仅能影响制剂的溶出行为,还能影响制剂的生物利用度。如














