《华尔街日报》网站在今年4月11日刊发报道称,中国崛起为生物技术药物强国。文章指出,中国正崛起为生物技术药物这类重要新药的主要生产国,这引起一些全球大型药企的注意,过去两年礼来和默克等制药公司于中国公司签署了价值数百万美元的协议,将中国研发的生物技术药品销往海外。文中引述一家向专门投资中国生物技术初创公司的风险投资基金合伙人的话说,“10年前中国甚至不在生物科技领域关注范围之内,但现在已经成为不容忽视的力量”。
全球著名财经类媒体做此论断,不像以往用词是“XX大国”,而是冠以“强国”,转至国内,立马引起行业热论,有认认为过于高估中国生物药企的研发实力,连“生物制药大国”都不是,何谈“生物制药强国”;也有行业专家认为,中国生物药研发已经具备强国气势。
从发展潜力的角度而言,生物药无疑是制药行业近年来发展最快的子行业之一,全球市场规模预计将从2016年的2020以美元上升到2022年的3260亿美元,年复合增速为8.3%。而中国市场规模由2012年的627亿元增长到2016年的1527亿元,年复合增长率达到24.9%。Frost&Sullivan预计2016~2021年中国生物药将保持16.4%的年复合增长率,到2021年达到3269亿元的市场规模,生物药将会成为中国医药行业最具前景的投资机会。
但是,中国真的已经崛起为“生物技术强国”了吗?中国有没有这样一批企业能够担当这样的重任?中国对于生物药研发构建起创新环境了吗?
老大说支持!谁敢说不?
毫无疑问,生物产业作21世纪创新最为活跃,影响最为深远的新兴产业,因此也是中国战略性新兴产业的主攻方向。“十二五”期间,国家层面将单克隆抗体、新型疫苗、重组蛋白等生物药作为重点扶持对象。而在“十三五”规划中提出的“推进健康中国建设”的八大措施中,7项措施与医药产业相关,其中生物医药是重中之重。
此外,在2015年两会期间,李克强在政府报告中提出,新兴产业和新兴业态是竞争的高地。当时所划定的八大新兴产业中,生物医药产业名列其中。而之后,在2016年国家出台了《2016~2020年生物医药产业振兴规划》,其要求加快推动生物产业作为国民经济的支柱产业,加快生物产业与其他产业融合,加快靶向药物、细胞治疗等技术发展。
由此,不难看出,生物医药的发展是国家的大战略,也是中国医药界参与国际竞争的战略切入点。从这个角度去看,接下来的生物医药发展,各项支持政策将会以前所未有的力度向这个领域倾斜。
而在具体的政策层面,国家这两年也在快速变革,以为生物医药的发展打造良好的发展环境。
单就从审评审批的角度而言,在上世纪90年代,由于中国的生物制药没有严格的审评制度,审批数量过多,造成了过度竞争,没有产生重磅产品。但是到了2007年之后,随着《药品注册管理办法》的出台,规定所有生物制品均按照新药来申报,限制了同一药品的企业数量。
之后,在2015年2月,CFDA发布《生物类似药研发与评价技术指导原则(试行)》,确定了生物类似药的监管框架,界定了生物类似药及参比药的定义,规定了技术审查的基本原则、比对标准和适应症外推的条件。该文件的出台,为中国生物药的发展奠定了政策基础。
而在2016年7月,《药品注册管理办法(修订稿)》则进一步规范了生物类似药的概念,严格了生物类似药的审批标标准。2017年3月,又对生物类似药的命名做出了规定,提出了如果是按照类似药的标准进行研究开发和临床试验的类似药可以和原研药用相同的名字,可考虑适应症外推。
而值得一提的是,CDE还允许企业走新药或生物类似药两条途径展开临床试验。走新药临床开发途径可避免在三期临床购买原研的巨额花费,同时也可避免无法达到与原研药相似的标准;而按照类药途径申请的生物类似药可能会获得适应症外推的利好,即一款药如果被证明在一个病症上和原研药相似,原研药的其它适应症也可直接适用于这款药。
由此而言,随着CFDA正在大刀阔斧的进行改革,越来越多有利于生物医药发展的政策出台,推出的MAH制度,还发布了生物类似药的申报指南、优先审评等政策都将为生物药发展提供有力支持。而按照CFDA的改革意图,在接下里对生物制品的注册制度上,将会以最快的速度向欧美靠近,从而鼓励企业参与全球同步开发,提升中国企业的全球竞争力。
而对于上市产品,国家层面对生物医药的支持也相当明显,在刚刚完成的国家医保谈判中,36个进入谈判目录的产品中,有14个为生物药,占比接近40%。在此前的一个内部会上,有国家高层曾直言,很多跨国企业的生物药在中国价格其高,但是本土又无类似药出现,以至于谈判中降价不易,所以希望本土药企加快研发速度,敢于挑战。
毫不讳言的讲,国家层面会有更多资源倾斜给本土生物药企,进行对外企高价生物药的专利挑战。那么,接下来,国家到底会怎么支持?
9月22日,由中国中农民族党中央医疗卫生•生物技术工作委员会指导,中国医药企业管理协会主办,E药经理人、中国医疗健康产业投资50人论坛承办的第九届中国医药企业家科学家投资家大会上,相关领导会到场进行解读。

研发实力有多强?
与美国相比,中国生物医药的发展起步晚。如果将美国生物医药发展划分阶段,其1980年开始以人胰岛素、干扰素、重组疫苗等为第一个发展阶段;第二个阶段为1990年之后,当时以生长因子、胰岛素类似物、TNF-α-Fe融合蛋白等生物药产品;2000年之后,进入第三阶段,以抗体偶联药物、抗体片断等为代表的产品;2015年之后,进入第四阶段,主打是免疫疗法、重组多克隆抗体、双特异性抗体等。
而中国的情况则是,1990年起步,在美国进入第二阶段时,中国才开始第一阶段的尝试,之后长期处于落后一代的状态。但是2015年,随着本土人才的长期储备,以及大量的热钱涌入,资本的助推之下,中国生物药研发呈现出百家争鸣状态,第三代与第四代同步进行,逐步走向了全球同步。

在这种起步晚的大背景下,中国研发者集中火力于生物类似药的研发,根据汤森路透的数据显示,在研生物类似药的主要分布地区不是在原研药发达的欧美,排名第一的是中国大陆,第二的是印度,第三的才是美国。
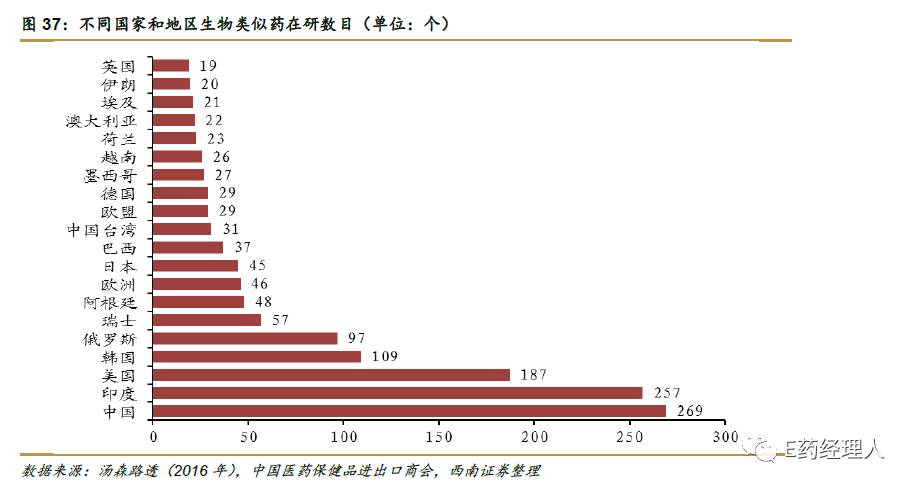
虽然到目前为止中国还未有严格意义上的生物类似药上市,但是可以看得到的是作为全球第一大生物类似药在研国,国内不少企业都在生物类似药上布局。根据汤森路透的报道显示,2016年康宁杰瑞在研生物类似药的数据已有28个之多。
从全球已经上市的生物医药市场角度来看,过去几年全球药物销量前10的药物中,生物药的比例逐年上升,2016年,8种为生物大分子药,其中有6个是单抗。所以,中国的生物药研发者也主要集中于单抗类的研发,在中国,在研单抗类似药的个数占国内在研类似药个数的比例为40.7%。
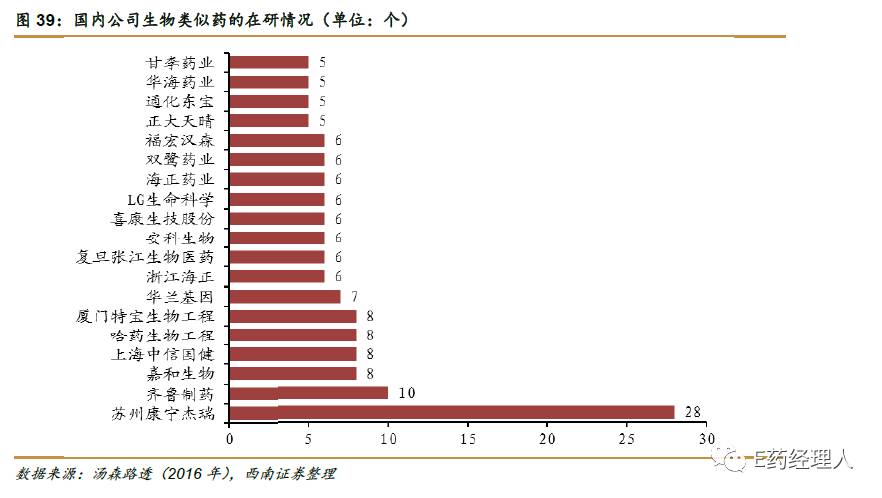
单就从大多企业集中在生物类似药的研发集中情况,排名第一这个角色而言,很多人可能认为中国生物药的研发还处在模仿阶段,并无太多科技实力,但是在业内人士看来,想要研发出生物类似药其实并不容易,其对科研能力的要求并亚于一个新药的研发。
而且,在生物类似药研发领域,中国已具备一定的产业基础。其中三生制药、恒瑞、丽珠、科伦等一大批具有生物药物开发能力的本土企业已经投入巨资,进行战略性布局。
此外,值得一提的是,很多企业也在进行原创性生物药研发的尝试。比如说,国内药企在PD-1/PD-L1的研发进度上,已经能够做到与全球同步,虽然还没有产品上市,但是已经有企业向跨国药企授权产品。被认为是跨时代的CAR-T细胞治疗技术,中国企业已经处在世界前列,甚至已经有些指标超越海外对标公司,比如金斯瑞研发的CD38和BCMA靶点治疗多发性骨髓瘤的CAR-T疗法,目前临床研究参与病人人数和试验结果都已经是世界第一。
由此来看,中国目前在生物医药领域的研发实力,虽然还无法称之为“强国”,但是“崛起”已经是不争的事实,所以,未来成长为“生物技术强国”并非遥远。但具体会有多远?在9月22日的第九届中国医药企业家科学家投资家大会上,主办方单设了一个“中国正努力实现制药强国梦”环节,房建民、龚兆龙、廖化新、罗文、吴劲梓、吴幼玲、徐霆、杨大俊、严海等“千人计划”专家、生物研发企业掌门人会对“中国崛起为生物医药强国”这一问题进行思考,给出答案!
如有兴趣,请点阅读原文报名。

中国生物药第一军团!
中国生物医药研发企业众多,且几乎有实力的企业都在布局,在这个时代,那家企业的研发管线中没有几个生物药,都很不好意思说自己的研发实力。
恒瑞:后来居上!
恒瑞医药作为中国医药的标杆性企业,在布局上绝不会缺席生物医药,但在业内,恒瑞医药在生物医药的研发方面,布局并不算早,其2012年才开始正式进军生物医药研发,但是由于研发基础实力强悍,其生物药研发后来居上,迅速地在业界崭露头角。其主打PD-1/PD-L1、抗体药物偶联物等生物药的研发。
其中,PD-1单抗是中国第二个获得WHO非专利药物名的国产生物药,目前已进入三期临床,而PD-L1单抗目前也已经批准进行临床试验;C-MetADC则是中国第一个获得FDA临床批准的抗体药物偶联物,目前国内尚无上市的同靶点的同类型产品;另外一个生物药为畅销聚乙二醇化重组人粒细胞集落刺激因子,属于一类创新药,目前该产品已处于保生产阶段,据估计,有望成为10亿元量级的重磅产品。
复星:资本撬动
在业内,复兴医药以长袖善舞的资本技能而著名,在布局生物药方面其依然如此,经过多年的布局,其在生物医药领域也颇有建树。在其发展中,紧抓产业发展前沿,打造生物类似药研发平台、与全球细胞免疫治疗先锋Kite合作打造免疫治疗平台,同时注重新药的引进和开发,子公司复宏汉霖用2000万美元从Kolltan引入新型肿瘤单抗药物KTN0216的开发权,在2016年也于韩国AbClon签署协议,获得新抗体药物只是产权和商业化权利。
而在其众多的布局当中,子公司复宏汉霖是其整个生物医药研发的战略中心所在,在单抗研发方面颇有领军者优势,其有数个创新型单抗布局,具有完全自主知识产权的HLX06已经完成IND申报。截止目前,复宏汉霖已经完成7个产品、12项适应症IND的申报,已经完成临床注册申报的前五个项目HXL01-HLX05为生物类似药,均为全球“重磅单抗”。
康弘:一战成名
康弘药业在合适点的落下生物药研发的重要一子——康柏西普,随着后者上市销售,让其在生物药研发领域迎来了大发展,成为谈论生物药创新中,无论是国家创新层面,还是资本层面都无法绕开的一个企业。
康柏西普(商品名:朗沐)是康弘原创一类生物新药,是新一代抗VEGF融合蛋白,也是中国首个获得WHO国际通用名的拥有的拥有全自主知识产权的生物一类新药。该产品上市之后,与全球巨头竞争,发展迅速,而且也有新适应症获批,且在美国越过一二期临床,直接进入三期临床试验,被业界寄予厚望。康柏西普之后,其基于VEGF机理的在研生物产品还有三个,KH901是治疗性肿瘤疫苗1类生物药,目前处在二期临床阶段;KH903用于结直肠及其他器官肿瘤;KH906用于眼表新生血管相关疾病,已获批临床。
丽珠集团:全线出发
丽珠集团利用生物制剂与诊断试剂业务在精准医疗领域的协同优势效应,构建起了“丽珠试剂+丽珠单抗+丽珠圣美+丽珠基因”精准医疗产业链,全面布局精准医疗。
在丽珠试剂方面主打IVD产品,分子诊断和化学发光研发加快;在单抗方面,有12个项目在研,包括10个生物制剂产品,其中CD20、HER2、TNFa、rhCG和PD-1处在临床Ⅰ~Ⅲ期,进展颇为迅速,已经处于国内第一梯队;丽珠圣美则主要是高端液体活检检测设备及试剂;丽珠基因:第三方实验室服务,落地精准诊断。其中,丽珠的PD-1单抗于2017年7月获美国FDA批准开展Ⅰ期临床。
百济神州:中国基因泰克















