
民告官!联合治疗公司(UTC)起诉FDA滥用自由裁量权
近日联合治疗公司( United Therapeutics Company, UTC)在哥伦比亚特区联邦地区法院对美国食品药品管理局 ( FDA ) 提起讼诉,因为美国FDA否定 UTC 公司的孤儿药 Orenitram 缓释片 ( Treprostinil,曲前列尼尔,一种用于治疗肺动脉高压的药物 ) 具有 7 年的市场独占期,并声明 UTC 提供临床依据以证明口服曲前列环素缓释片的临床有效性,安全性或病人护理方面优于曲前列环素其它剂型后方可获得7年的市场独占期。
但UTC公司认为,既然FDA认定ORENITRAM (曲前列尼尔口服缓释片)为用于治疗肺动脉高压(PAH)的孤儿药,就应该同时具有7年的市场独占期。FDA让其提供额外的临床证明违反行政程序法,是滥用自由裁量权。因此,UTC公司起诉美国FDA,要求其赋予UTC公司的孤儿药ORENITRAM(treprostinil)缓释片7年的市场独占期。
|
自古以来,民告官难于上青天!
药企状告药审部门的事几乎是不可能发生的事,可为什么UTC要起诉FDA呢,且听文竹娓娓道来。
孤儿药 ( 也称“罕见病药” ) 是指可用于治疗、诊断及预防罕见疾病的药品。
罕见病其实是一个区域性概念,各国根据自己国内某种疾病的发病率来判定是否为罕见病。在美国,孤儿药在美国的认定标准为:用于治疗患病人数<20万的药品或者产品在美国的预期销售额无法覆盖其研发以及上市申请过程中的花费。
20 世纪 80 年代之前,孤儿药市场还处于自由竞争状态。由于罕见病的发病率低,目标人群少,企业利润空间小,药企研发和生产孤儿药的积极性较低。 1983 年,为了鼓励药企研发孤儿药的积极性,保障国民的生命健康权益,解决药物可及性问题,美国政府颁布了《孤儿药法案》(ODA)。此后,美国国会分别于 1984 年、 1985 年、 1988 年、 2007 年对 ODA 进行了修订,使法律条文更加具体,完善。现今的孤儿药法案鼓励政策如下:
1. 税收抵免
孤儿药临床试验费用的 50% 可以作为税收抵免,并可向前延伸 3 年,向后延伸15 年。
2. 免除新药申请费
美国 FDA 规定孤儿药的新药申请(new drug application,NDA)费用可以免除。例如,美国 FDA 在 2014 财政年的 NDA 费用为 220 万美元/药。
3. 减免临床病例数
由于罕见病的临床患病人数少,难以满足 III 期临床试验病例要求,因此,往往得以减免临床试验例数,从而可以减少临床费用,加快注册进程。
4. 研发资助
自 1983 年以来,美国 FDA 其孤儿药资助计划已资助了 500 多项临床研究,其中有 45 个孤儿药已获 FDA 上市批准。 FDA 对孤儿药的资助预算为 1410 万美元/财政年,其中,I 期临床研究最多可获得 25 万美元/年×3年的补助, II 期、 III 期临床最多可获得50万美元/年×4年的补助。
5. 优先审评券
优先审评券(PRV)是美国 FDA 对成功开发儿童罕见病药物企业的奖励,使用该券可使开发商其他任何药物获得优先审评资格,从而使该药物的审评周期从标准的 10 个月缩短为 6 个月。开发者也可将该券卖给另外一家公司。
2015 年,联合治疗公司凭借其治疗儿童罕见病——高危成神经细胞瘤的新药Dinutuximab(Unituxin)的成功上市获得了一张优先审评券,随后UTC以3.5亿美元的价格将优先审评券转让给了美国生物技术巨头艾伯维(AbbVie)。这足以见证优先审评券价值可见一斑。
6. 市场独占权
已认定的孤儿药经美国 FDA 批准上市后可享有 7 年的市场独占权( 从NDA/BLA 批准开始算起),该保护不受专利的影响。在此期间, FDA 不再批准针对相同适应证的同分子结构药物,除非该药被撤回,或该药的持有者许可,或该药供应不足,或新申报的药物更具临床优越性。因此,若一药品拥有市场独占期后,孤儿药的生产厂家可根据市场可接受的最高价格定价,并且在7年内没有竞争对手。从某种意义上说,数据独占权可弥补药企在FDA审批时所损失的时间,延长药品的在市场上的销售时间。最大程度的促进了医药企业的产品占领销售市场,回收研发投入。
受以上实质性政策的激励,以及罕见病病多药少,靶点确定的特点,使孤儿药研发具有研发投入少,研发周期短,投资回报高的特点。因此,开发孤儿药成为了许多医药公司的重要发展策略。
肺动脉高压(PAH)是一种恶性罕见疾病,主要表现为肺血管压力和阻力的持续性升高,最终可导致患者右心衰竭直至死亡。肺动脉高压可以是特发性的,也可以伴随其他疾病出现,例如:结缔组织疾病、先天性心脏病、肺栓塞以及服用食欲抑制剂、 HIV 病毒感染等原因。患者平均年龄约为 36 岁。
目前中国尚未有权威的统计机构对肺动脉高压患者总数进行统计,但根据欧美国家文献报告,动脉型肺动脉高压的患病率为 15/106 ,特发性肺动脉高压患病率为 6/106 。如按西方国家 PAH 发病率数据初步估算,我国大约有几千到一万人患病。
肺动脉高压病情凶险,预后较差,因此被称为心血管领域的癌症, 80 年代美国国立卫生研究院(NIH)首次对肺动脉高压进行注册登记研究结果显示:特发性肺动脉高压患者的 1 年、 3 年和 5 年生存率分别为 68% 、 48% 和 34% ,中位生存期为 2.8 年。近年来随着治疗技术的不断发展,肺动脉高压到预后也有了显著改善,同时也为肺动脉高压药品的开发商带来丰厚到回报。
2016年,全球抗 PAH的品牌药销售总额达到史无前例的57亿美元,整个PAH药物市场可能已突破60亿美元 ( 详见图1 ) 。
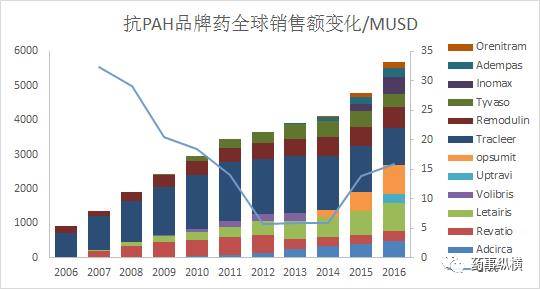
图1 2006 - 2016 年全球抗 PAH 药物市场态势
联合治疗公司 ( UTC ) & Orenitram
1. UTC :以开发罕见病药物为主业务的百折不挠的科技型公司
成立于1996年,总部位于马里兰州银泉市的 UTC 是一家生物科技公司。尽管 UTC 目前仅有5个上市产品,但却有4个品种为孤儿药,分别为 Orenitram ( 曲前列尼尔口服缓释片 ) , Remodulin ( 瑞莫杜林曲,曲尼地尔注射剂 ) ,Tyvaso ( 曲尼地尔吸入制剂 ) 、Unituxin(Dinutuximab)。以此看来, UTC 就是一家以开发孤儿药为发展策略的制药公司。 UTC 近10年来各产品历年销售额情况详见图2。
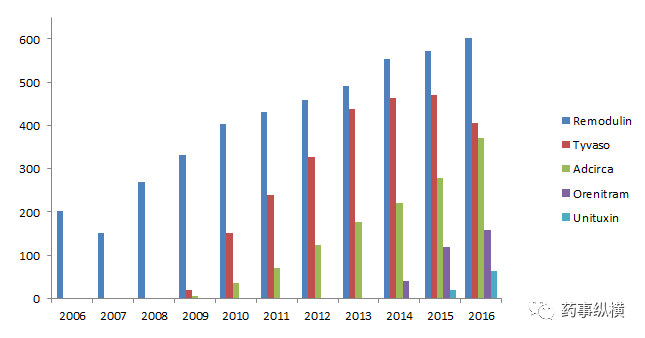
图 2 近10年UTC各产品历年销售情况(单位:百万美元)
UTC 主要致力于开发治疗罕见病肺动脉高压的药物, 并对其开发的新药曲尼地尔的市场价值进行了深度挖掘,该药品从上市到现在 15 年来一直享受着开发孤儿药的红利。 2002 年该公司开发的新药Remodulin获得了孤儿药授权并享有市场独占期; 2009 年改剂型的 Tyvaso 也获得了孤儿药授权并享有市场独占期,同年该公司的仿制药他达拉非也获得批准上市; 2013 年 UTC 又开发了曲前列尼尔口服缓释片Orenitram 被批准上市并被认定为孤儿药(详见图-3)。
2016年 UTC的四个抗PAH药物的年销售额占据了公司年销售总额的96%(15.36亿美元),也占据了抗PAH药品全球销售额的四分之一。
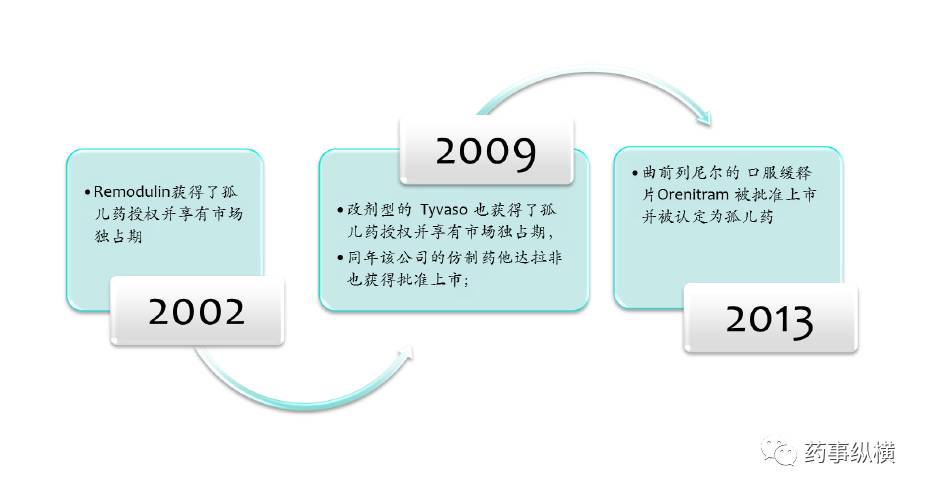
图- 3 UTC抗PAH药物的上市过程
2. Orenitram :多次上市申请被拒的传奇药物
UTC 的 Orenitram 作为引发这次诉讼事件的主角,其申请作为孤儿药上市的过程也是相当曲折。 2012 年 10 月份 FDA 以 UTC 不能证明临床试验期间进行 6 分钟行走试验患者的试验结果具有统计学意义为由拒绝了 UTC 的首次申请, 2013 年 3 月份 FDA 以该药物需要重新进行临床试验为由再次拒绝了 UTC 的二次申请,拒绝的当天 UTC 公司股票在纳斯达克证券市场就下跌了 7% 。在这种几乎不被看好的情况下, UTC 在 2013 年再次向 FDA 提出孤儿药的新药申请,还并未附带任何另外数据。结果居然在 2013 年 12 月 20 日被 FDA 批准了。可谓惊天大逆转,在这里我们必须为 UTC 百折不挠的精神点赞。
无独有偶!美国 FDA 史册上类似遭遇估计并不止是 UTC 的 Orenitram ,不信,你看!
2012 年 DepoMed 公司也曾因为其孤儿药 Gralise ( 加巴喷丁胃滞留片,一种用于治疗带状疱疹后神经的药物 ) 的市场独占期问题碰到了与 UTC 的 Orenitram 类似遭遇而控诉 FDA ,并且获得了当时美国地方法院法官 Ketanji Jackson 的支持。不过 FDA 对 Jackson 法官的裁决完全置之不理,只是在 FDA 法律博客上发文讨论了这个案例,并且重申将按照现行标准来决定是否授予某个药物孤儿药资格。
此次 UTC 就 FDA 否认该药物具有 7 年的市场独占期的行为违反行政程序法而起诉 FDA ,能否再次上演奇迹,并在这场民告官的诉讼中胜诉大家拭目以待。不过,无论结果如何,文竹认为 UTC 公司这种不畏公共权力,敢于一切从法律角度出发和行政部门“叫板”的精神值得国内医药行业从业者学习。
— 留声机 —
关于美国 FDA
在美国国民心中FDA是最值得信任的政府机构之一,它是一个科学性的监管机构,其工作是科学和法律的结合。为保证美国公民的健康与安全,确保在伤害发生之前就做到预防伤害,法律规定从来都不是FDA行为的决定性因素。
在美国医药公司起诉FDA的事情并不罕见,但是,一般在法庭上,FDA的专业决定——不论是许可、不予许可或延迟审批都不会受到质疑。法规条款从未事实性地影响这个机构进行审评的行为方式和节奏,也不能影响到FDA对那些想获得上市许可的申报者必须提交数据的具体要求。即使联邦法院判决FDA败诉,多半挑战的是FDA工作程序的正当性、合法性。因此,对一个医药公司来说FDA可谓掌握了生杀大权。
参考文献
【1】杜涛,高翼 美国孤儿药开发的策略与实践 药学进展
【2】United Therapeutics Sues FDA After Agency Denies Orphan Drug Exclusivity for ORENITRAM
更多干货请进药事纵横主页:www.pharmaguider.cn

药事纵横是一个开放,由自愿者组成的团体,现有成员14名,分别为Voyager88,雷诺岛,三分话,Herman,梅希,文竹,duke,巉石,ISAL,yhqqqqq,鲁礼炎,占小兵,越下里两毛,溜溜,欢迎有志之士加入我们团队。投稿、合作请加微信442015666。















