2016年,人福医药以5.5亿美元收购美国Epic Pharma及附属企业(Epic Pharma公司是一家具备多个优势品种的成熟仿制药企业,之前是山德士制药Sandoz的一个子公司)。通过收购Epic Pharma,再加上其核心子公司宜昌人福获得的ANDA批文,人福医药目前拥有24个ANDA制剂文号。
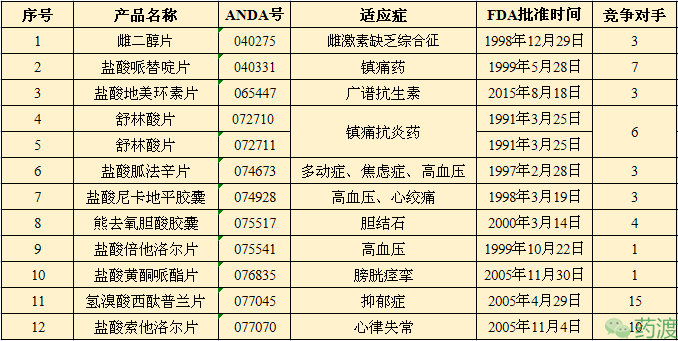
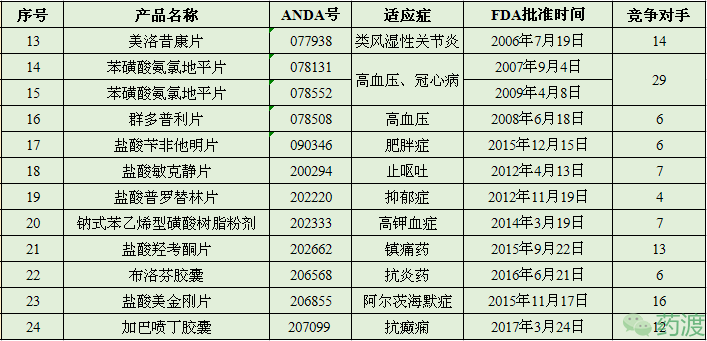
注:竞争对手的数量仅按产品名称统计,忽略规格等其它方面的异同。
英文:Estradiol Tablets
ANDA:040275
适应症:雌激素缺乏综合征
规格:0.5mg、1mg和2mg
子公司:EPIC PHARMA
批准时间:1998年12月29日
雌二醇(E2)是一种甾体类雌激素,也是最主要的一种雌激素。雌二醇主要是用于促进和维护女性生殖器官如乳房、子宫等的发育与平衡,具有很强的性激素作用。雌二醇在1935年首次由温特斯坦纳等(Wintersteiner et al)从马尿中提取出来。1999年诺和诺德(Novo Nordisk)以新剂型方式率先获得雌二醇片的NDA。雌二醇片目前有11个ANDA,其中7个已撤市。
产品:盐酸哌替啶片
英文:Meperidine Hydrochloride Tablets
ANDA:040331
适应症:镇痛药
规格:50mg和100mg
子公司:EPIC PHARMA
批准时间:1999年05月28日
哌替啶为人工合成的阿片受体激动剂,属于苯基哌啶衍生物,是一种临床应用的合成镇痛药,其作用和机理与吗啡相似,但镇静、麻醉作用较小,仅相当于吗啡的1/10—1/8。长期使用会产生依赖性,被列为严格管制的麻醉药品,1939年由Otto Eisleb合成。哌替啶主要用于治疗中度至重度疼痛。1942年11月10日US PHARM率先获得盐酸哌替啶片的NDA申请批准,商品名为DEMEROL®。盐酸哌替啶片目前有12个ANDA,其中4个已撤市。
产品:盐酸地美环素片
英文:Demeclocycline Hydrochloride Tablets
ANDA:065447
适应症:广谱抗生素
规格:150mg和300mg
子公司:EPIC PHARMA
批准时间:2015年08月18日
地美环素是一种半合成的四环素类抗生素,抗菌谱与四环素相近,具有高效和长效性质,在四环素类中该品抗菌作用最强,适用于治疗大部分类型的细菌感染。盐酸地美环素片的原研公司为Lederle制药,1960年01月获得盐酸地美环素胶囊的NDA,于同年11月获得盐酸地美环素糖浆的NDA,最后于1964年09月22日获得盐酸地美环素片的NDA,商品名均为DECLOMYCIN®,现均已撤市。盐酸地美环素片目前有5个ANDA,其中1个已撤市。
产品:舒林酸片
英文:Sulindac Tablets
ANDA:072710/072711
适应症:镇痛抗炎药
规格:150mg/200mg
子公司:EPIC PHARMA
批准时间:1991年03月25日
舒林酸是一种非甾体内的抗炎药,属于前体药,进入人体后代谢为硫化物,该硫化物具有抑制环氧化酶,减少前列腺素合成的活性,具有消炎、镇痛、解热的作用,对环氧化酶的抑制作用较舒林酸强500倍。本药的抗炎作用为阿司匹林的16倍,吲哚美辛的2倍。镇痛作用是布洛芬的10倍,但解热作用比布洛芬弱。舒林酸片的原研公司为Merck制药,1978年09月获得FDA批准的NDA,商品名为CLINORIL®,现已撤市。盐酸地美环素片目前有14个ANDA,其中6个已撤市。
产品:盐酸胍法辛片
英文:Guanfacine Hydrochloride Tablets
ANDA:074673
适应症:多动症、焦虑症、高血压
规格:EQ 1MG BASE和EQ 2MG BASE
子公司:EPIC PHARMA
批准时间:1997年02月28日
胍法辛是一种选择性a2A受体抑制剂的抗交感神经药物,主要用于治疗注意缺陷障碍(ADHD)、焦虑症以及高血压。2010年胍法辛被FDA批准用于治疗6-17岁青少年的ADHD。盐酸胍法辛片的原研公司为PROMIUS制药,1986年10月获得FDA批准的NDA,商品名为TENEX®;2009年09月02日,SHIRE公司获得盐酸胍法辛缓释片的NDA,商品名为INTUNIV®。盐酸胍法辛片目前有5个ANDA,其中1个已撤市;盐酸胍法辛缓释片目前有6个ANDA,其中1个已撤市。
产品:盐酸尼卡地平胶囊
英文:Nicardipine Hydrochloride Tablets
ANDA:074928
适应症:高血压、心绞痛
规格:20mg和30mg
子公司:EPIC PHARMA
批准时间:1998年03月19日
盐酸尼卡地平是一种二氢吡啶(DHP)类的钙通道抑制剂,通过抑制Ca2+流入血管平滑肌细胞而发挥血管扩张作用;也能抑制磷酸二酯酶,使脑冠状动脉及肾血流量增加,从而起到降压作用。临床上主要用于治疗高血压和心绞痛。盐酸尼卡地平胶囊的原研公司为CHIESI制药,1988年12月获得FDA批准的NDA,商品名为ARDENE®,现已撤市;又于1992年02月获得盐酸尼卡地平缓释胶囊的NDA,商品名为CARDENE SR®,也已撤市。盐酸尼卡地平胶囊目前有4个ANDA,其中1个已撤市。
产品:熊去氧胆酸胶囊
英文:Ursodiol Capsules
ANDA:075517
适应症:胆结石
规格:300mg
子公司:EPIC PHARMA
批准时间:2000年03月14日
熊去氧胆酸最早是从熊的胆汁中分离出来的,是鹅去氧胆酸的7β-羟基差向异构体,现在已能通过多种途径进行化合合成。熊去氧胆酸在临床上用于增加胆汁酸分泌,并使胆汁成分改变,降低胆汁中胆固醇及胆固醇脂,有利于胆结石中的胆固醇逐渐溶解,用于不宜手术治疗的胆固醇结石。熊去氧胆酸胶囊的原研公司为Allergan销售公司,1987年12月获得FDA批准的NDA,商品名为ACTIGALL®,批准规格为150mg和300mg,其中150mg现已撤市。熊去氧胆酸胶囊目前有5个ANDA,均未撤市。
产品:盐酸倍他洛尔片
英文:Betaxolol Hydrochloride Tablets
ANDA:075541
适应症:高血压
规格:10mg和20mg
子公司:EPIC PHARMA
批准时间:1999年10月22日
倍他洛尔是一种选择性β1受体阻滞药,几乎不阻断β2受体,并具有钙离子拮抗作用,无内源性拟交感活性(ISA),有一定的膜稳定作用(MSA),一般用于治疗高血压(口服)和青光眼(滴眼液)。1985年08月,Alcon获得盐酸倍他洛尔滴眼液的NDA,商品名为BETOPTIC®,用于治疗青光眼;1989年10月Sanofi获得盐酸倍他洛尔片的NDA,商品名为KERLONE®,现已撤市。盐酸倍他洛尔片目前仅有2个ANDA。
产品:盐酸黄酮哌酯片
英文:Flavoxate HydrochlorideTablets
ANDA:076835
适应症:膀胱痉挛
规格:100mg
子公司:EPIC PHARMA
批准时间:2005年11月30日
黄酮哌酯是一种平滑肌松弛药,具有抑制腺苷酸环化酶、磷酸二酯酶的作用以及拮抗钙离子作用,并有弱的抗毒蕈碱作用,对泌尿生殖系统的平滑肌具有选择性解痉作用,因而能直接解除泌尿生殖系统平滑肌的痉挛,使肌肉松弛,消除尿频、尿急、尿失禁及尿道膀胱平滑肌痉挛引起的下腹部疼痛,临床上主要用于治疗膀胱痉挛。盐酸黄酮哌酯片的原研公司为Ortho-McNeil-Janssen,于1970年01月获得FDA批准的NDA,商品名为URISPAS®,现已撤市。盐酸黄酮哌酯片目前仅有3个ANDA,其中1个已撤市。
产品:氢溴酸西酞普兰片
英文:Citalopram Hydrobromide Tablets
ANDA:077045
适应症:抑郁症
规格:EQ 40MG BASE、EQ 20MG BASE和EQ 10MG BASE
子公司:EPIC PHARMA
批准时间:2005年04月29日
氢溴酸西酞普兰是一选择性5羟色胺再吸收抑制剂,具有抗抑郁作用,1998年被FDA批准用于治疗重度抑郁症。值得一提的是,氢溴酸西酞普兰对胆碱能毒蕈碱受体、组织胺受体和α-肾上腺素能受体均无抑制作用。氢溴酸西酞普兰于1972年由一些科学家们首次被合成出来,1989年首次在丹麦面市。1998年07月,Forest Labs获得FDA批准的NDA,商品名为CELEXA®,氢溴酸西酞普兰片开始了在美国上市。氢溴酸西酞普兰片目前有26个ANDA,其中10个已撤市。
产品:盐酸索他洛尔片
英文:Sotalol Hydrochloride Tablets
ANDA:077070
适应症:心律失常
规格:80mg、120mg和160mg
子公司:EPIC PHARMA
批准时间:2005年11月04日
索他洛尔是一种β-肾上腺素能受体阻断剂,具有III类抗心律失常药物延长动作电位时程兼有β1、β2受体阻滞作用的广谱抗心律失常药物,对室上性、室性心律失常均有较好的疗效。由于其能使QT间期延长并不会威胁生命,故被FDA认为是唯一的能用于治疗重度心律失常的药物。索他洛尔于1960年首次被合成出来,1974年面市于英国和法国,1975年面市于德国,1979年面市于瑞典,直到1992年才获得FDA的批准。1992年10月,Covis制药获得FDA批准的盐酸索他洛尔片NDA,商品名为BETAPACE®,盐酸索他洛尔片开始了在美国上市(部分规格已撤市)。盐酸索他洛尔片目前有16个ANDA,其中5个已撤市。
产品:美洛昔康片
英文:Meloxicam Tablets
ANDA:077938
适应症:类风湿性关节炎
规格:7.5mg和15mg
子公司:PURACAP PHARM
批准时间:2006年07月19日
美洛昔康是一种非甾体抗炎药(NSAID),具有止痛和退烧的作用,主要用于类风湿性关节炎的症状治疗,疼痛性骨关节炎(关节病、退行性骨关节病)的症状治疗。2000年04月,勃林格殷格翰(Boehringer-Ingelheim)首次获得FDA批准的美洛昔康片的NDA,又于2004年06月获得美洛昔康混悬液的NDA,商品名均为MOBIC®。2015年10月,IROKO制药公司获得其胶囊制剂产品的NDA。美洛昔康片目前有22个ANDA,其中7个已撤市。
产品:苯磺酸氨氯地平片
英文:Amlodipine Besylate Tablets
ANDA:078131/078552
适应症:高血压、冠心病
规格:EQ 2.5MG BASE、EQ 5MG BASE和EQ 10MG BASE
子公司:PURACAP PHARM/EPIC PHARMA LLC
批准时间:2007年09月04日/2009年04月08日
苯磺酸氨氯地平是二氢吡啶类钙拮抗剂(钙离子拮抗剂或慢通道阻滞剂),能选择性抑制钙离子跨膜进入平滑肌细胞和心肌细胞,对平滑肌的作用大于心肌,一般用于治疗高血压和冠心病,属于WHO基本药物之一。苯磺酸氨氯地首次面向市场是在1990年。1992年07月,辉瑞(Pfizer)首次获得FDA批准的苯磺酸氨氯地平片NDA,商品名为NORVASC®。苯磺酸氨氯地平片目前有37个ANDA,其中6个已撤市。
产品:群多普利片
英文:Trandolapril Tablets
ANDA:078508
适应症:高血压
规格:1mg、2mg和4mg
子公司:EPIC PHARMA
批准时间:2008年06月18日
群多普利是一种血管紧张素转化酶抑制剂(ACE),本身无活性,在体内转化成群多普利拉后发挥作用,转化率相当于依那普利的2.3~10倍,作用出现时间迟而维持时间长。临床主要用于治疗动脉高血压,也适用于治疗各种程度的高血压病。群多普利片的原研公司为ABBVIE(2013年为雅培Abbott的子公司),于1996年04月首次获得FDA批准的NDA,商品名为MAVIK®。群多普利片目前有10个ANDA,其中3个已撤市。
产品:盐酸苄非他明片
英文:Benzphetamine Hydrochloride Tablets
ANDA:090346
适应症:肥胖症
规格:50mg
子公司:EPIC PHARMA
批准时间:2015年12月15日
苄非他明是苯丙胺的前体药,属于刺激剂类。在医生的批准下,可用于减少体重,适合于通过锻炼和节食后仍肥胖的患者,主要是减少热量的摄入。盐酸苄非他明片的原研公司为Pharmacia and Upjohn,于1960年10月首次获得FDA批准的NDA,商品名为DIDREX®,现已撤市。盐酸苄非他明片目前有9个ANDA,其中2个已撤市。
产品:盐酸敏克静片
英文:Meclizine Hydrochloride Tablets
ANDA:200294
适应症:止呕吐
规格:12.5mg和25mg
子公司:EPIC PHARMA
批准时间:2012年04月13日
敏克静(也称“美克洛嗪”)是一种第一代抗组织胺药(非选择性H1受体拮抗剂),用于各种皮肤粘膜过敏疾病,亦可用于妊娠、放疗及晕动症引起的恶心、呕吐。1957年02月,Casper Pharma首次获得FDA批准的盐酸敏克静片和咀嚼片的NDA,商品名为ANTIVERT®,现均已撤市。盐酸敏克静片目前有31个ANDA,其中23个已撤市。
产品:盐酸普罗替林片
英文:Protriptyline Hydrochloride Tablets
ANDA:202220
适应症:抑郁症
规格:5mg和10mg
子公司:EPIC PHARMA
批准时间:2012年11月19日
普罗替林是一种三环类抗抑郁药(TCA),是一种选择性抑制中枢和外周NA摄取,对5-HT系统几无影响,与其他三环类抗抑郁药相比,拮抗α1受体、H1受体和M受体的作用较弱一般用于治疗抑郁、多动症(ADHD)。盐酸普罗替林片的原研公司为TEVAWOMENS,1967年09月获得FDA批准的NDA,商品名为VIVACTIL®,现已撤市。盐酸普罗替林片目前有5个ANDA。
产品:钠式苯乙烯型磺酸树脂粉剂
英文:Sodium Polystyrene Sulfonate Powder
ANDA:202333
适应症:高钾血症
规格:453.6 GM/BOT
子公司:EPIC PHARMA
批准时间:2014年03月19日
苯乙烯型磺酸树脂是一种从聚苯乙烯衍生而来的聚合物,广泛用作为一种离子交换树脂,从而替换掉过多的钾、钠、钙等离子。钠式苯乙烯型磺酸树脂主要是降低体内钾盐过多,用于治疗急慢性肾功能衰竭、肾病综合征、狼疮性肾炎、肝肾综合征等并发的高钾血症。钠式苯乙烯型磺酸树脂粉剂的原研公司为Concordia制药,于1958年06月获得FDA批准的NDA,商品名为KAYEXALATE®。钠式苯乙烯型磺酸树脂粉剂目前有10个ANDA,其中2个已撤市。
产品:盐酸羟考酮片
英文:Oxycodone Hydrochloride Tablets
ANDA:202662
适应症:镇痛药
规格:5mg、10mg、15mg和30mg
子公司:EPIC PHARMA
批准时间:2015年09月22日
羟考酮(Oxycodone)是从生物碱蒂巴因(thebaine)中提取的半合成阿片类药物,由Freund和Speyer两位科学家于1916年在德国Frankfurt大学最先提出去,作为强效镇痛药在临床上应用已有80多年的历史。由于羟考酮生物利用度高,给药途径多,因而在临床上应用广泛。但在临床发现在高剂量连续使用羟考酮后,突然中断或减量,部分病人有戒断综合征的发生,这提示羟考酮同样具有其它阿片类药物常见的不良反应。FDA于1997年批准盐酸羟考酮控释片用于治疗需要服用数天阿片类镇痛药物的中、重度疼痛患者。1998年10月Roxane公司获得FDA批准的盐酸羟考酮缓释片NDA;2003年08月Mallinckrodt公司以新剂型方式获得FDA批准的盐酸羟考酮片NDA,商品名均为ROXICODONE®。盐酸羟考酮片目前有14个ANDA。
产品:布洛芬胶囊(OTC)
英文:Ibuprofen Capsule
ANDA:206568
适应症:非甾体抗炎药
规格:EQ 200MG FREE ACID AND POTASSIUM SALT
子公司:HUMANWELL PURACAP
批准时间:2016年06月21日
布洛芬是一种非甾体抗炎药(NSAID),是世界卫生组织、美国FDA唯一共同推荐的儿童退烧药,是公认的儿童首选抗炎药,一般用于抗炎、镇痛、解热。布洛芬也可用于治疗风湿和类风湿关节炎,但疗效稍逊于乙酰水杨酸和保泰松。布洛芬于1961年被Stewart Adams和John Nicholson两位科学家发现,最早是在1969年于英国上市,1974年开始在美国上市,是WHO基本药物之一。Mcneil Consumer公司于1974年09月以NME形式获得FDA批准的布洛芬片NDA,商品名为MOTRIN®,现以撤市。1995年04月,辉瑞(Pfizer)以新剂型方式获得布洛芬胶囊的NDA。布洛芬胶囊目前有9个ANDA,其中2个已撤市。
产品:盐酸美金刚片
英文:Memantine Hydrochloride Tablets
ANDA:206855
适应症:阿尔茨海默症
规格:5mg和10mg
子公司:PURACAP PHARM LLC
批准时间:2015年11月17日
美金刚是第一个新型的治疗阿尔茨海默病的药物,能够阻断NMDA受体,一般用于用于治疗中重度至重度阿尔茨海默型痴呆。1968年由礼来(Eli Lilly)首次合成用于治疗糖尿病,后发现在降低血糖方面没有什么效果,在1980年后才被发现具有阻断NMDA受体的作用。1989年美金刚首次以治疗痴呆症在德国上市。2003年10月Forest Labs以NME获得FDA批准的盐酸美金刚片NDA,商品名为NAMENDA®。盐酸美金刚片批文是人福获得的第一个ANDA批文,是该公司多年在美国仿制药市场耕耘的第一个成果,具有里程碑意义。盐酸美金刚片目前有20个ANDA,其中预批准为2个,撤市已1个。根据IMS 数据,2014年盐酸美金刚片在美国市场的总销售额约为12亿美元。
产品:加巴喷丁胶囊
英文:Gabapentin Capsule
ANDA:207099
适应症:抗癫痫
规格:100mg、300mg和400mg
子公司:EPIC PHARMA
批准时间:2017年03月24日
加巴喷丁是一种新颖的抗癫痫药,能对抑制性递质γ-氨基丁酸(GABA)产生作用,但具体作用基质不明。加巴喷丁可用于治疗癫痫、神经性疼痛和不安腿综合征(RLS)。加巴喷丁被认为是治疗神经性疼痛(如糖尿病神经病变)的一线药物之一。加巴喷丁是由美国Warner-Lanbert公司首先开发,1993年首次在英国上市。1993年12月,辉瑞(Pfizer)以NME获得FDA批准的加巴喷丁胶囊NDA,商品名为NEURONTIN®,但只是用于辅助治疗成人患者的部分癫痫发作的治疗;2000年将治疗延伸至儿童患者。加巴喷丁胶囊目前有21个ANDA,其中1个为预批准,7个已撤市。
人福医药年报显示,2016年公司实现营业收入123.31亿元,同比增长 22.65%,实现归属于上市公司股东的净利润8.32亿元,同比增长27.31%,其中归属于上市公司股东的扣非净利润为5.65亿元,同比增长0.02%。这些指标超过同行业平均水平。
海外业务是人福医药2016年业绩的亮点。公司公告资料介绍,目前,人福医药的海外业务已覆盖欧美成熟市场以及南美、东南亚、西非等地区。美国市场是人福医药海外拓展的重点。
据悉,目前美国普克、宜昌人福有超过50个ANDA在研,而Epic Pharma有37个产品在不同的研发阶段,其中超过10个产品已经向FDA申报。如果人福医药依托美国普克、Epic Pharma和宜昌人福几个子公司的研发产品全部获批,人福医药将拥有超过100个ANDA批文,有望成为美国排名前10的一线仿制药企。
声明:
本文由药渡头条投稿作者撰写,观点仅代表作者本人,不代表药渡头条立场,欢迎交流补充。联系方式:010-82826195 转8048
如需转载,请务必注明文章作者和来源
投稿详情请点击“4月-5月 | 王牌写手获奖名单”