

摘
要:目的
探讨黄葵四物方对尿毒素分子硫酸对甲酚(
p
-cresyl sulfate
,
PCS
)在宿主细胞内的代谢通路及转运环节的影响,并初步探讨其作用机制。
方法
采用超高效液相色谱
-
三重四级杆质谱仪(
ultra performanceliquid chromatography-triple quadrupole/mass spectrometry
,
UPLC-TQ/MS
)检测黄葵四物方干预后血浆及脏器内
PCS
水平的变化。采用酶活法检测肝脏内
PCS
合成酶磺基转移酶的活力。采用
qRT-PCR
及
Western blotting
检测结肠和肝脏中磺基转移酶及肾脏中有机阴离子转运体的基因转录和蛋白表达水平。
结果
黄葵四物方可降低动物血浆或肝脏中
PCS
水平。黄葵四物方显著下调肝脏内磺基转移酶基因转录和蛋白表达水平(
P
<
0.05
),抑制肝脏中对甲酚向
PCS
转化,从而抑制宿主体内尿毒素分子
PCS
的合成。黄葵四物方不影响肾脏中有机阴离子转运体的基因转录和蛋白表达水平,不影响
PCS
由血液向肾脏中的转运过程。
结论
黄葵四物方可通过调控宿主细胞内
PCS
的合成途径,抑制
PCS
体内合成,减少尿毒素蓄积,从而延缓慢性肾病进程。
慢性肾病(
chronic kidney disease
,
CKD
)是一个世界性的公共卫生问题,全球发病率约为
10%
,其中
20%
~
30%
的患者将会发展为终末期肾病,造成巨大的社会和经济负担
[1-2]
。全球疾病负担研究表明,预计到
2040
年,
CKD
将成为导致人类死亡的第
5
大原因
[3]
。随着
CKD
进展,肾功能不断衰竭,体内代谢产生的氮质废物不能及时排出体外,在体内不断堆积形成的对机体有毒性的物质称作尿毒素。按照相对分子质量及物理化学特性,可以将尿毒素分为小分子质量尿毒素(如肌酐
/
尿素氮)和中分子质量尿毒素(如甲状旁腺素)和蛋白结合型尿毒素
[4]
。其中,蛋白结合型尿毒素因与血浆蛋白结合率高而命名,其相对分子质量大,临床透析治疗不能将其去除,在终末期肾病患者体内大量堆积,极大地降低了
CKD
患者的生活质量和存活率
[5]
。
硫酸对甲酚(
p
-cresol sulfate
,
PCS
)是蛋白结合率高达
95%
的蛋白结合型尿毒素,终末期肾病患者体内
PCS
含量超出正常人
10
倍
[6]
。过量的
PCS
在
CKD
患者体内蓄积,进一步加剧肾脏和心血管的损伤,加快
CKD
的进展。
PCS
具有肾毒性,可诱导肾脏纤维化,加剧肾脏炎症反应
[7]
,诱导肾小管细胞及肾小管近端细胞的凋亡,增加
CKD
患者的发病率和死亡率
[8]
。在心血管系统,
PCS
可刺激血管内皮微粒子释放,诱导血管内皮细胞损伤,同时,可诱导内皮细胞和血管平滑肌细胞的氧化应激,加剧
CKD
患者的血管损伤
[9]
。
中药被认为是一种成本低、效益高的治疗手段,几十年来,中药治疗慢性重大疾病的有效性和安全性研究取得了很大的进展,越来越多的患者受益于中药。本课题组在临床治疗
CKD
药物黄葵胶囊的基础上,进一步优化得到中药复方黄葵四物方。该复方是由黄葵、黄芪、虎杖和姜黄
4
味中药配伍而成。
组方具有清利活血、通淋消肿、补泻同施、标本兼顾之功。本课题组前期研究发现,黄葵四物方可显著减轻
CKD
模型大鼠的肾脏炎症及纤维化水平;显著抑制
CKD
模型大鼠血浆、肝脏和肾脏中尿毒素分子
PCS
的蓄积
[10]
,提示黄葵四物方保护
CKD
的作用可能与其抑制体内
PCS
蓄积相关。
PCS
在宿主体内合成及转运过程主要包括
2
个环节。
PCS
的合成环节:食物中的酪氨酸被肠道菌群分解产生对甲酚,对甲酚可在结肠和肝脏内被磺基转移酶
(
sulfotran-sferase1a1
,
SULT1A1
)
代谢合成
PCS
;
PCS
的转运环节:血浆中的
PCS
经由肾脏阴离子转运体(
organic anion transporter
,
OAT
)转运进入肾脏细胞并最终通过尿
液排泄
[8]
。最新研究表明,中药通过干预肠道菌群可有效改善
CKD
、心血管疾病等多种慢性疾病
[11-14]
。
本课题组前期研究发现黄葵四物方可作用于肠道菌群,调控肠道菌群中
PCS
前体分子对甲酚的合成途径,抑制肠道菌群中对甲酚的合成。然而,黄葵四物方是否影响
PCS
在宿主细胞中的合成环节以及向肾脏内的转运环节尚不清楚。因此,本研究进一步探究黄葵四物方对尿毒素
PCS
在宿主细胞内的合成及转运环节的影响。
1.1
仪器
ChemiDoc
XRS
凝胶成像系统(美国
BIO-RAD
公司);
7500 Real Time PCR
仪(美国
Applied Biosystems
公司);超高效液相色谱三重四极杆质谱联用(
Ultraperformance liquid chromatography-triple quadrupole/mass spectrometry
,
UPLC-TQ/MS
)和高效液相色谱
-
紫外
-
荧光检测器(
high performance
liquid chromatography-ultraviolet/fluorescencedetector
,
HPLC-UV-FLD
)均购自美国
Waters
公司;
Microcl 21R
常温低速离心机(
Thermo
公司)。
1.2
实验动物
SPF
级
C57BL/6
雄性小鼠,体质量
18
~
25 g
和
SPF
级
SD
雄性大鼠,体质量
180
~
220 g
,购自北京维通利华实验动物技术有限公司,许可证号:
SCXK
(北京)
2015-0001
,动物合格号:
NO.201807103
。动物饲养在室温
20
~
26
℃,相对湿度
40%
~
70%
,光照约
12 h
明暗交替的屏障环境动物房。每日提供符合标准的动物饲料及饮用水,供动物自由摄食和饮水。动物研究遵循南京中医药大学动物伦理委员会的指导方针(伦理审核号
201805A002
)。
1.3
药物及试剂
黄葵(批号
180901
)、黄芪(批号
180401
)、虎杖(批号
180501
)、姜黄(批号
180201
)均购于安徽省万生中药饮片有限公司,经南京中医药大学段金廒教授鉴定,符合《中国药典》规定,均为正品。对甲酚(批号
BCBR6678V
)、
PCS
(批号
3233-58-7
)和腺苷
-3′-
磷酸
-5′-
磷酰硫酸锂盐水合物
(
adenosine-3′-phosphate-5′-phosphate lithium phosphate
,
PAPS
,批号
101154-201001
)均购于美国
Sigma- Aldrich
公司。氯霉素(批号
F1805109
)、苯巴比妥钠(批号
2015062
)购于中国材料研究中心。生理盐水购于山东齐都药业有限公司。
Trizol
试剂和引物购于美国
Thermo Fisher Scientific
公司;
EasyScriptOne-Step gDNA Removal and cDNA Synthesis SuperMix
和
TransStart Top Green qPCR SuperMix
购于北京全式金生物技术有限公司。抗体购于美国
Proteintech
公司。质谱级乙腈购于德国
Merck
公司。质谱级甲酸购于天津科密欧有限公司。
2
方法
2.1
黄葵四物方溶液的制备
称取适量黄葵、黄芪、虎杖、姜黄粉末,按照
3.5
︰
5
︰
1.5
︰
1
的比例混匀,
60%
乙醇提取
3
次,每次
1.5 h
,提取液合并进行浓缩,浓缩后生药量
2g/mL
,其中主要药效成分质量分数分别为毛蕊异黄酮苷
0.35 mg/g
、虎杖苷
2.54 mg/g
、金丝桃苷
3.90 mg/g
、异槲皮苷
2.56 mg/g
、槲皮苷
0.29 mg/g
、杨梅素
0.85 mg/g
、白藜芦醇
13.42 mg/g
、毛蕊异黄酮
0.22 mg/g
、槲皮素
0.06 mg/g
、姜黄素
1.25 mg/g
、大黄素
0.54 mg/g
。
2.2
PCS
的
UHPLC
-TQ/MS
分析
2.2.1
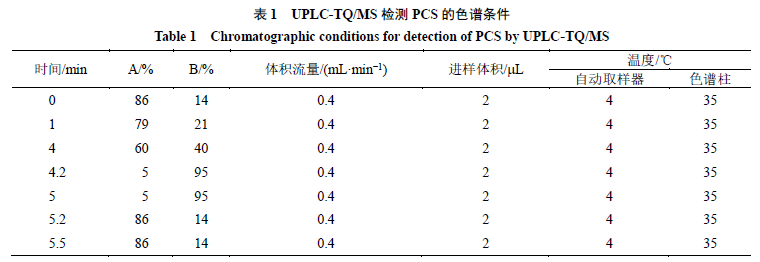
色谱条件
采用
Acquity UHPLC
TM
系统、
Acquity UHPLC BEH C
18
色谱柱(
100 mm
×
2.1 mm
,
1.7
m
m
)进行色谱分析。流动相为
0.1%
甲酸水(
A
)和乙腈(
B
),具体色谱参数见表
1
。
2.2.2
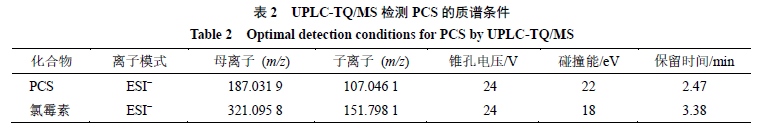
质谱条件
采用
Xevo Triple Quadrupole Mass Spectrometer
(
TQ/MS
)、选择性反应检测法进
行质谱分析。检测参数:毛细管电压为
3.0 kV
,离子源温度为
150
℃,脱溶剂温度为
550
℃,锥孔气
流速度为
50 L/h
,脱溶剂气体积流量为
1000L/h
。
PCS
质谱检测条件见表
2
。
2.3
黄葵四物方对宿主体内
PCS
合成的影响
2.3.1
黄葵四物方对小鼠体内
PCS
含量的影响
将
10
只
C57BL/6
雄性小鼠随机分为
2
组,分别为正常组和黄葵四物方组,每组
5
只。对照组小鼠
ig
无菌超纯水,黄葵四物方组小鼠
ig
黄葵四物方水溶液(
2.5 g/kg
[10]
),连续
ig 28 d
。第
28
天,对照组和黄葵四物方组小鼠
ig
对甲酚(
80 mg/kg
),
2 h
后进行眼眶取血。实验结束后,将小鼠用苯巴比妥钠(
0.1 mL/10 g
)麻醉,采集小鼠结肠和肝脏,脱颈椎处死小鼠。
将血液样品
4000 r/min
离心
10 min
,离心后取上清即得血浆。称取脏器样品于
EP
管内,每克样品加入
1 mL PBS
溶液,
60 Hz
,
90 s
匀浆后,
13 000 r/min
离心
10 min
,取上清。所有样品以
10
∶
1
比例加入
200 μg/mL
氯霉素作为内标物,再以
1
∶
3
比例加入乙腈,充分混匀,
13 000 r/min
离心
10 min
,取上清至进样小瓶中,置于冰上。按照“
2.2
”项的方法测定
PCS
含量。
2.3.2
黄葵四物方对小鼠肝脏中
SULT1A1
活性的影响
实验分组和给药同“
2.3.1
”项。称取各组小鼠肝脏,按
1
∶
4
(
mg/L
)的比例加缓冲溶液(将
5 mmol/L
的
MgCl
2
·6H
2
O
溶解在
100 mmol/L pH 7.4
的
Tris-HCl
中),
2
颗钢珠,
60 Hz
、
90 s
匀浆,
4
℃,
13 000 r/min
离心
20 min
,取上清液。将上清液在
37
℃中孵育
3 min
,取
240 μL
上清液加
10 μL 250 mol/L PAPS
(
3′-
磷酸腺苷
-5′-
磷酰硫酸,底物,为对甲酚提供硫酸基团,促进对甲酚合成
PCS
),
37
℃孵育
0
、
5
、
30
、
60 min
,孵育完成后,加
0.3 mL
甲醇终止反应。涡旋后离心(
12 000 r/min
、
10 min
),取上清液至进样小瓶。通过
HPLC-UV-FLD
分析上清液中
PCS
含量,采用
C
18
柱(
250 mm
×
4.6 mm
,
5
m
m
,
Alltima
,美国),柱温为
35
℃,进样时间为
5.5 min
,波长为
260
~
300 nm
,流动相为乙酸铵
-
乙腈(
75
︰
25
)。通过计算单位时间内
PCS
生成量反映小鼠肝脏中
SULT1A1
的酶活性。
2.3.3
黄葵四物方对小鼠
结肠和肝脏中
SULT1A1 mRNA
和蛋白表达的影响
实验分组和给药同“
2.3.1
”。将小鼠结肠、肝脏组织置于
Trizol
试剂中
进行研磨裂解,
12 00
0×
g
离心
10 min
,取上清,加入氯仿萃取静置分层,
12 000
×
g
离心
15 min
,取最上层溶液,加入异丙醇充分混匀,静置,
12 000
×
g
离心
10 min
,弃上层液体,加入
75%
乙醇涡旋,
7500
×
g
离心
5 min
,取上清,
3
次,弃去液体,倒扣晾干,加入
DEPC
水复溶
mRNA
,并按照逆转试剂盒说明书获得互补
DNA
(
complementary DNA
,
cDNA
)。使用
PCR
基因扩增仪进行扩增。
PCR
反应每个样品进行
3
次重复实验,
PCR
扩增反应条件为
94
℃预变性
30 s
,然后进入循环阶段,每个循环包括
94
℃变性
5 s
,
60
℃退火
34 s
,
72
℃延伸
30 s
,共
45
个循环。最
终以目的基因与
甘油醛
-3-
磷酸脱氢酶(
glyceraldehyde-
3-phosphatedehydrogenase
,
GAPDH
)的含量比值表示目基因的表达水平。使用的引物序列见表
3
。扩增数据按照
2
−ΔΔ
C
t
的方法进行数据处理。

将小鼠的结肠、肝脏组织用
RIPA
裂解液以及蛋白酶抑制剂
Cocktail
进行裂解,蛋白浓度用
BCA
试剂盒(
Pierce Protein Biology
,
Rockford
,
IL
,美国)进行检测。配制浓缩胶和
10%
的分离胶,并加入相同蛋白含量的样品进行样品分离,用
PVDF
膜转膜。
5%
牛奶室温封闭
PVDF
膜
1 h
,封闭后用
SULT1A1
抗体(
1
︰
1000
)稀释,
4
℃过夜孵育,然后用对应的二抗进行孵育,曝光,获得目的蛋白及内参蛋白(
α-tubulin
)的灰度值。
2.3.4
黄葵四物方对大鼠体内
PCS
合成环节的影响
将
15
只
SD
雄性大鼠随机分为
3
组,分别为对照组、对甲酚组和黄葵四物方组,每组
5
只。对照组大鼠每日上午
ig
生理盐水
1
次,对甲酚组及黄葵四物方组大鼠每日上午
ig
对甲酚水溶液(
40 mg/kg
)
1
次,此外,黄葵四物方组大鼠每日下午
ig
黄葵四物方水溶液(
1.25 g/kg
[10]
)
1
次,连续
ig 10 d
。第
11
天,
ig
对甲酚
5 min
后,黄葵四物方组
ig
黄葵四物方,
1 h
后眼眶取血,采集的血液置于含有
15 g/L EDTA
水溶液的
EP
管中。取血后,
ip 2.0%
苯巴比妥钠溶液(
30 mg/kg
)麻醉大鼠。用
4
℃的
PBS
作为灌流液灌注。实验结束后,大鼠已经死亡。采集大鼠结肠、肝脏和肾脏。血液和脏器样品处理同“
2.3.1
”项,按照“
2.2
”项的方法测定
PCS
含量。
2.4
黄葵四物方对宿主体内
PCS
转运的影响
2.4.1
黄葵四物方对小鼠体内
PCS
转运进入肾脏的影响
取
C57BL/6
雄性小鼠
9
只,随机分为
2
组,对照组为
4
只,黄葵四物方组为
5
只。对照组每日
ig
生理盐水
1
次;黄葵四物方组
ig
黄葵四物方水溶液(
2.5 g/kg
),连续
ig 28 d
。第
28
天,对照组和黄葵四物方组小鼠
ip PCS
(
20 mg/kg
),
0.5 h
后眼眶
取血。实验结束后,用
2.0%
苯巴比妥钠(
0.1 mL/10 g
)
麻醉小鼠,采集小鼠肾脏,脱颈椎处死小鼠。血液和脏器样品处理同“
2.3.1
”项,按照“
2.2
”项的方法测定
PCS
含量。
2.4.2
黄葵四物方对小鼠肾脏中机阴离子转运体
OAT1/3 mRNA
和蛋白表达的影响
实验分组和给药同“
2.4.1
”项。取小鼠肾脏组织加入
2
颗钢珠并用
Trizol
试剂进行研磨裂解,
12 000
×
g
离心
10 min
,取上清,加入氯仿萃取静置分层,
12 000
×
g
离心
15 min
,取最上层溶液,加入异丙醇充分混匀,静置,
12 000
×
g
离心
10 min
,弃上层液体,加入
75%
乙醇涡旋,
7500
×
g
离心
5 min
,取上清,
3
次,弃去液体,倒扣晾干,加入
DEPC
水复溶
RNA
,仪器检测。并按照逆转录试剂盒说明书转录得到互补的
cDNA
,最终使用
PCR
基因扩增仪进行扩增。
PCR
反应每个样品进行
3
次重复实验,
PCR
扩增反应条件为
94
℃预变性
30 s
,然后进入循环阶段,每个循环包括
94
℃变性
5 s
,
60
℃退火
34 s
,
72
℃延伸
30 s
,共
45
个循环。最后以目的基因与
GAPDH
的含量比值表示目基因的表达水平。使用的引物序列见表
3
。扩增数据按照
2
−ΔΔ
C
t
的方法进行数据处理。
将小鼠的肾脏组织用
RIPA
裂解液以及蛋白酶抑制剂
Cocktail
进行裂解,蛋白浓度用
BCA
试剂盒进行检测。配制浓缩胶和
10%
的分离胶,并加入相同蛋白含量的样品进行样品分离,用
PVDF
膜转膜。
5%
的牛奶室温封闭
PVDF
膜
1 h
,封闭后用
OAT1
、
OAT3
抗体(
1
︰
1000
)稀释,
4
℃过夜孵育,然后用相应的二抗进行孵育,曝光,获得目的蛋白及内参蛋白
GAPDH
的灰度值。
2.4.3
黄葵四物方对大鼠体内
PCS
转运进入肾脏的影响
取
SD
雄性大鼠
16
只,随机分为
2
组,分别为正常组和黄葵四物方组,每组
8
只。对照组
ig
生理盐水,黄葵四物方组
ig
黄葵四物方(
1.25 g/kg
),连续
ig 28 d
。第
28
天,对照组和黄葵四物方组大鼠
ip PCS
(
10 mg/kg
),
0.5 h
后眼眶取血;取血后,
ip 2.0%
苯巴比妥钠溶液(
30 mg/kg
)麻醉大鼠,在
ip PCS 1 h
后,对大鼠进行腹主动脉取血,后用
4
℃的
PBS
作为灌流液灌注。实验结束后,大鼠已经死亡,采集大鼠肾脏。血液和脏器样品处理同“
2.3.1
”,按照“
2.2
”项的方法测定
PCS
含量。对大鼠肾脏中机阴离子转运体
OAT1/3 mRNA
和蛋白表达量的测定同“
2.4.2
”项方法。
2.4.4
黄葵四物方对
CKD
模型大鼠
肾脏中
OAT1
和
OAT3
mRNA
表达的影响
将
18
只
SD
雄性大鼠随机分为
2
组,模型组和黄葵四物方组各
9
只。制备
CKD
模型:两组大鼠每日
ig
腺嘌呤溶液(
200 mg/kg
),连续
ig 2
周。造模结束后,各组大鼠静养
1
周。
1
周后开始给药,模型组每日
ig
超纯水,黄葵四物方组每日
ig
黄葵四物方(
1.25 g/kg
),连续
ig 56 d
。实验结束后,用
2.0%
苯巴比妥钠溶液(
30 mg/kg
)麻醉大鼠,用
4
℃的
PBS
作为灌流液灌注。实验结束后,大鼠已经死亡。采集大鼠肾脏。大鼠
肾脏中
机阴离子转运体
OAT1
和
OAT3
mRNA
表达量的测定同“
2.4.2
”项方法。
2.5
统计学方法
采用
GraphPad Prism version 7.0
软件进行数据统计分析。所有数据均以表示(
n
≥
3
)。采用
Nonparametric Mann-Whitney Test
进行组间差异性分析。
3
结果
3.1
黄葵四物方对宿主细胞内
PCS
合成的影响
本课题组前期研究发现黄葵四物方可降低慢性肾病模型大鼠血浆、肝脏及肾脏中
PCS
的含量,但尚不明确黄葵四物方是干预了
PCS
的合成环节和
/
或抑制
PCS
向肾脏内的转运环节,从而抑制宿主体内
PCS
蓄积。因此,本研究首先针对结肠和肝脏内
PCS
的合成环节,探讨黄葵四物方对宿主细胞内
PCS
合成的影响。
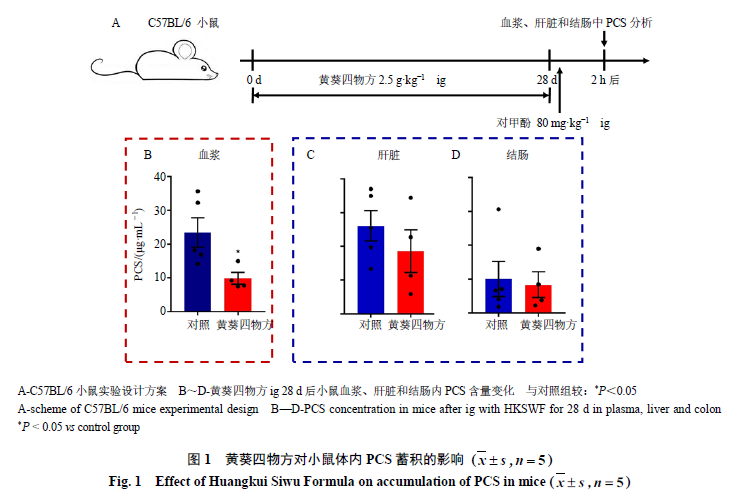
对甲酚
ig
给予小鼠后可被肠黏膜和肝脏中
SULT1A1
代谢生成
PCS
,小鼠血浆及肾脏内
PCS
水平也相应增加
[4]
,可进一步观察黄葵四物方对
PCS
合成环节的影响。黄葵四物方预给药
28 d
后,各组小鼠
ig
对甲酚
2 h
后,利用
UPLC-TQ/MS
检测小鼠血浆、结肠及肝脏内
PCS
含量(图
1-A
)。结果发现,与对照组相比,黄葵四物方可显著降低小鼠血浆中
PCS
的含量(图
1-B
),表明黄葵四物方可干预对甲酚向
PCS
转化的过程。结肠和肝脏是对甲酚向
PCS
转化的关键部位,检测结肠和肝脏中
PCS
含量,结果发现,黄葵四物方对肝脏中
PCS
的蓄积具有一定的抑制趋势(图
1-C
),不影响肠道中
PCS
蓄积(图
1-D
),以上结果提示黄葵四物方可能通过干预小鼠肝脏中
PCS
的合成,从而减少宿主体内
PCS
蓄积。
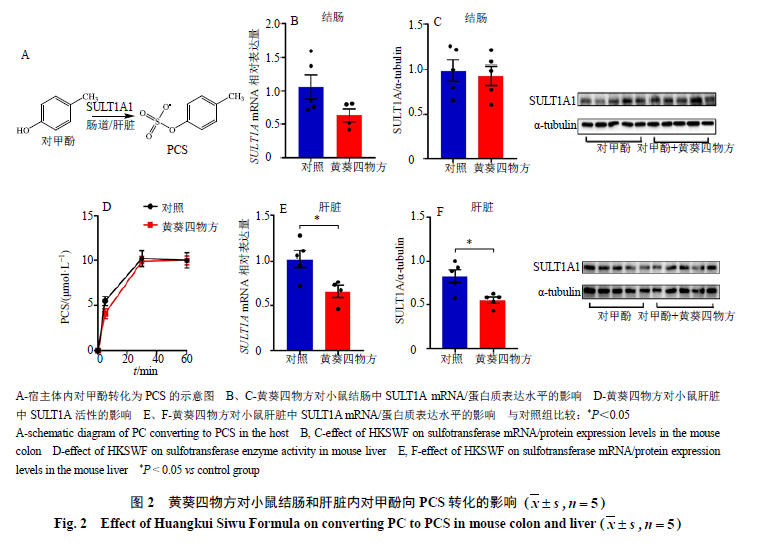
文献报道
PCS
主要由肠黏膜和肝脏内
SULT1A1
代谢对甲酚生成
[4]
。
因此,本研究进一步分析黄葵四物方对肠道和肝脏中
SULT1A1
的影响(图
2-A
)。利用
Westen blotting
和
PCR
方法检测结肠和肝脏中
SULT1A1
基因和蛋白的表达水平,结果发现,与对照组相比,黄葵四物方对结肠内
SULT1A1
基因的表达水平存在抑制趋势(图
2-B
),
但不影响其蛋白水平的表达(图
2-C
),提示黄葵四物方可能不影响肠道内对甲酚向
PCS
转化过程。黄葵四物方可显著抑制肝脏内
SULT1A1
基因和蛋白的表达水平(图
2-E
、
F
);此外,酶活力检测结果发现,黄葵四物方不影响肝脏内
SULT1A1
的酶活力(图
2-D
)。以上结果表明,黄葵四物方抑制小鼠体内
PCS
蓄积可能与调控肝脏内
SULT1A1
水平有关。
为了对以上结果进行验证,进一步观察了黄葵四物方对大鼠体内
PCS
合成环节的影响。大鼠
ig
对甲酚及黄葵四物方后,利用
UPLC-TQ/MS
检测血浆、结肠、肝脏和肾脏内
PCS
含量(图
3-A
)。结果发现,与对照组(未给予对甲酚)相比,对甲酚
ig
可显著升高
PCS
在血浆和肾脏内的含量,给予黄葵四物方后,大鼠血浆和肾脏内
PCS
含量存在降低趋势(图
3-B
、
C
)。在结肠和肝脏的检测结果中发现,与对照组相比,对甲酚













