药事纵横
美国
FDA
于
10
月
4
日发布安全警告:同时感染乙肝病毒(
HBV
)和丙肝病毒(
HCV
)病毒的患者在服用直接作用的抗丙肝病毒药物(
DAAs
)时,面临体内乙肝病毒再激活风险(一般在用药后
4-8
周
HBV
被激活)。在某些病例中,可能导致严重肝脏疾病甚至死亡。基于此,
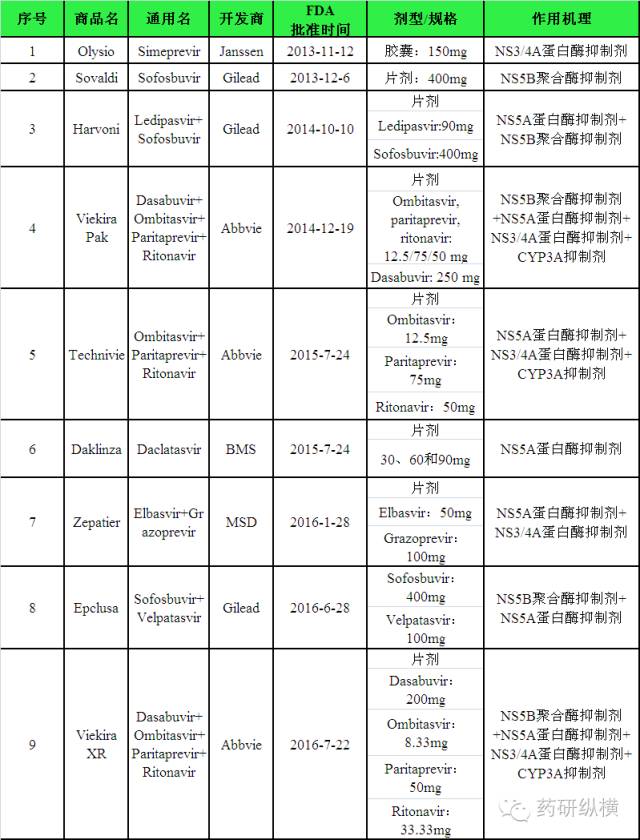
FDA
以下
9
个
DAAs
丙肝新药(详见表
1
)的药品标签上添加黑框警告,以警示
HBV
再活化的风险。在这
9
个
DAAs
丙肝新药中,
Gilead
和
Abbvie
各
3
个,
Janssen
、
BMS
和
MSD
各
1
个。
表
1
标签中添加黑框警告的
9
个
DAAs
疾病情况
丙型肝炎病毒(
HCV
)是由丙肝病毒感染引起的,丙肝病毒感染流呈现全球流行状态,是导致肝硬化和肝癌的最主要病因。血液和体液传播是
HCV
感染的主要途径,静脉吸毒与性传播是感染
HCV
的高危行为,同时约有
10%
~
30%
的感染原因不明。来自
WHO
的数据显示,全球
HCV
的感染率约为
2.8%
,约
1.85
亿人感染
HCV
,每年因
HCV
感染导致的死亡病例约
35
万例。
2006
年全国血清流行病学调查显示,我国
1
~
59
岁人群抗
HCV
流行率为
0.43%
,在全球范围内属
HCV
低流行地区,由此推算,我国一般人群
HCV
感染者约
560
万,如加上高危人群和高发地区的
HCV
感染,约
1000
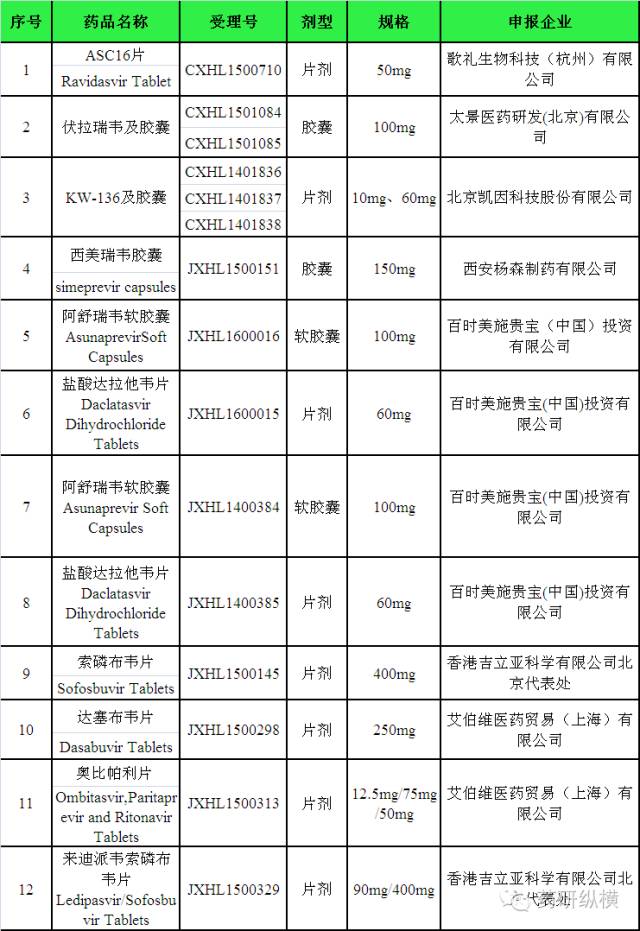
万例。目前我国尚未有
DAAs
类药物上市。为解决我国丙肝患者用药的可及性,
2016
年
4
月
18
日月我国
CDE
发文将表
2
中的抗丙肝药物注册申请拟纳入优先审评程序。由此可见,在
FDA
于发布安全警告的
9
个药物中,有
5
个药物拟进入优先审评程序。
表
2
我国
CFDA
列入优先审评的抗丙肝药物
专利情况
我国是仿制药大国,为给国内企业提供上述
9
大丙肝药物在中国的知识产权保护情况,笔者就上述
9
大丙肝药物在中国的专利情况进行了梳理,如下。
表
3
原研公司在中国申请的与
Olysio
相关的核心专利情况
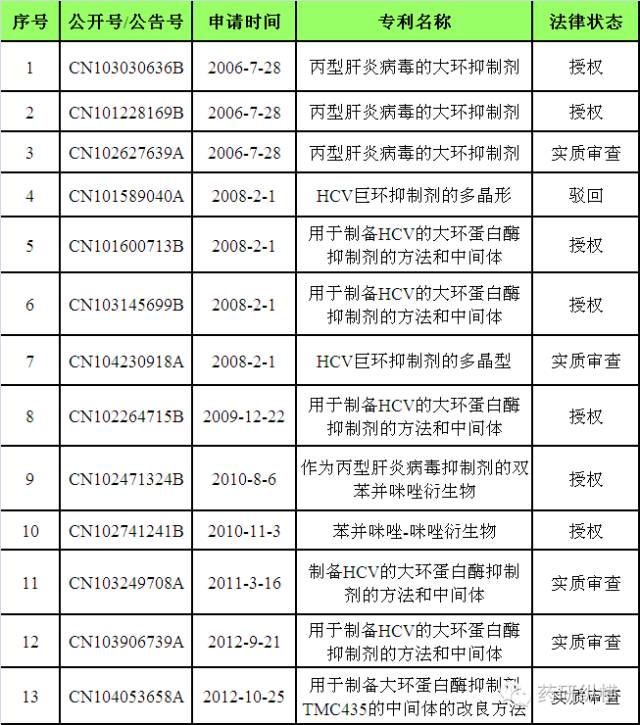
小结:目前,已有七项与
Olysio
相关的核心专利获得授权,分别是
CN103030636B
、
CN101228169B
、
CN101600713B
、
CN103145699B
、
CN102264715B
、
CN102471324B
和
CN102741241B
。
表
4
原研公司在中国申请的与
Sovaldi
相关的核心专利情况
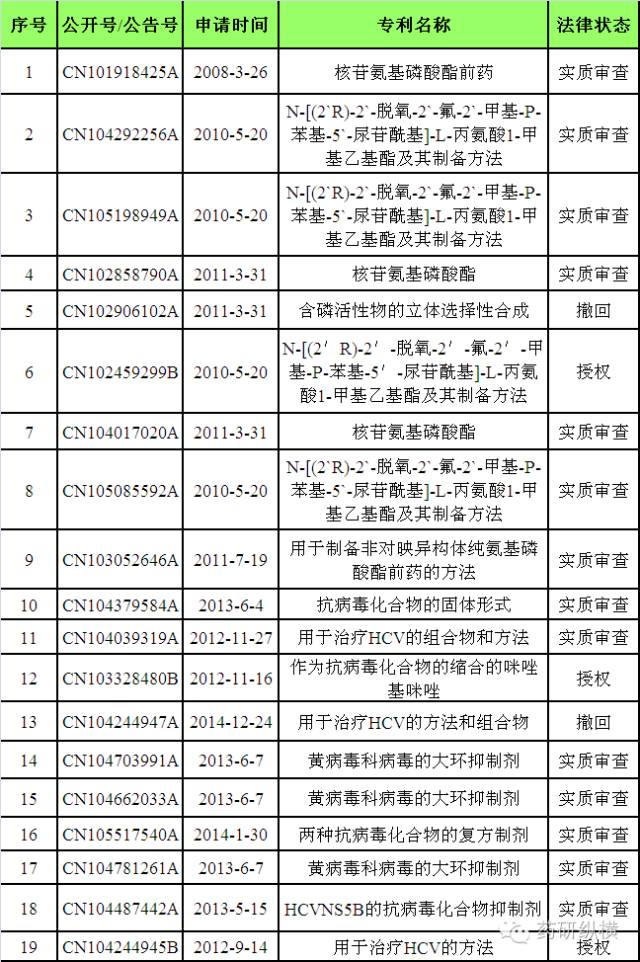
小结:目前,原研公司已有三项与
Sovaldi
相关的核心专利已获得授权,分别是
CN102459299B
、
CN103328480B
和
CN104244945B
。
表
5
原研公司在中国申请的与
Harvoni
相关的核心专利情况
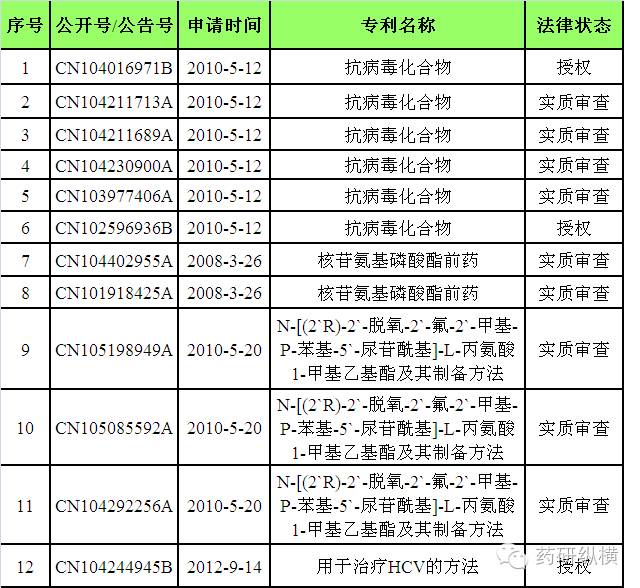
小结:目前,原研公司已有三项与
Harvoni
相关的核心专利
CN104016971B
、
CN102596936B
和
CN104244945B
已获得授权。
表
6
原研公司在中国申请的与
Viekira Pak/Viekira XR
相关的核心专利情况
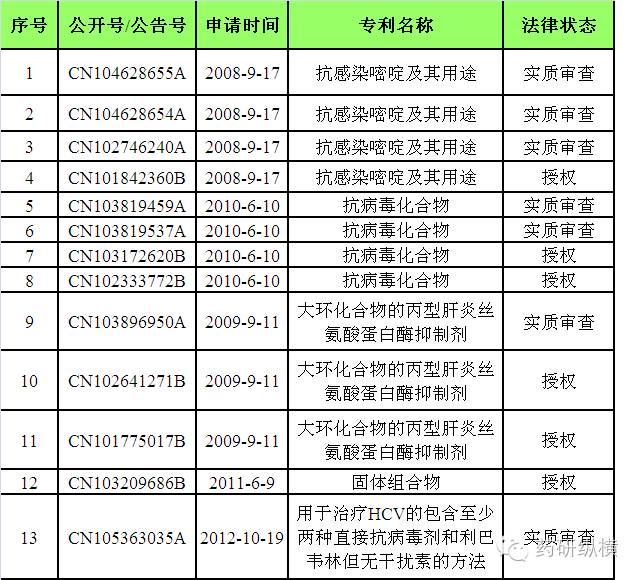
小结:目前,原研公司已有六项与
Viekira Pak
相关的核心专利授权,分别是
CN101842360B
、
CN102333772B
、
CN102333772B
、
CN102641271B
、
CN101775017B
和
CN103209686B
。
表
7
原研公司在中国申请的与
Technivie
相关的核心专利情况
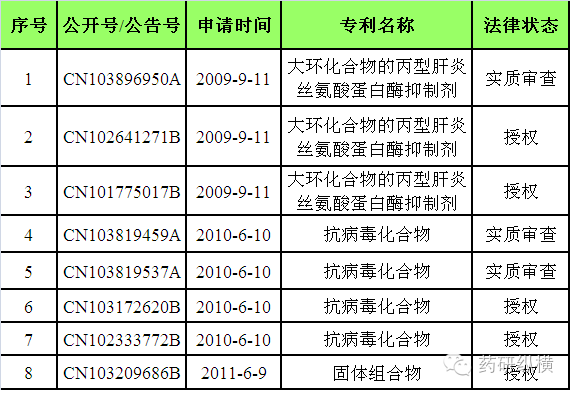
小结:目前,原研公司有两项
与
Technivie
相关的核心专利已获得授权,分别是
CN102641271B
和
CN101775017B
。
表
8
原研公司在中国申请的与
Daklinza
相关的核心专利情况
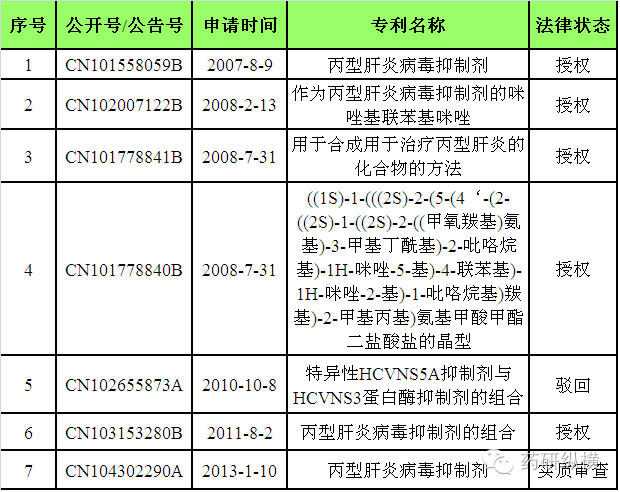
小结:目前,原研公司
与
Daklinza
相关的五项核心专利
CN101558059B
、
CN102007122B
、
CN101778841B
、
CN101778840B
和















