作者:仲夏秋夜云 来源:蒲公英
今天被朋友圈刷屏,说是诺华的CAR-T疗法Tisagenlecleucel(CTL-019)批准了。
所以身边不少医生朋友接到了一堆电话,当然也有不少人通过微信或者站内联络我。好像不说两句就没有蹭热度,不够关注行业动态似的,所以我就来说两句。
1.
这次多个自媒体说的“批准”事实上FDA专家委员会10:0投票推荐批准其BLA申请(生物制品执照申请),而最终的审评结果应该是10月3日出来
也就是说,这个和你看到国内CDE审评开会有的一拼,专家通过了,批件没说拿到。对了,FDA当然显得更为……反正这次投票是就预示着结果板上钉钉。
2.适应症是ALL
。
也就是复发或难治性儿童和年轻人急性淋巴细胞白血病。
请注意,这里除了急性淋巴细胞白血病之外,有一系列的定语。包括儿童或年轻人、复发或难治性……需要强调的是,诺华该产品在临床方案中,对于临床入组要求是很高的,包括了各种基因检测。也就是说,并不存在该方法一出,“所有肿瘤都将治愈”的说法。
3.他的申请中,核心数据包括了PD-1免疫检查点抑制剂的内容,也就是说,这里说的产品包括了和PD-1的联用临床数据
目前的关于细胞治疗关键性问题“复发率”,诺华的CTL-019控制得很好,82%缓解,58%出现3/4级细胞因子风暴,但并像之前的几个产品一样出现恶性死亡事件。FDA对外发布了审评文件。
资料显示,Study B2202研究入组的88例ALL患者有63例是在美国完成的CAR-T制备和输注。复发性,63例中52例应答,其中40例在输注后的前3个月内实现完全缓解(观察到肿瘤消失),29例一年内维持缓解,六个月后无复发率75%。52例产生应答患者的中位随访时间4.8个月,中位应答持续期数据尚未获得。29例患者在诺华提交BLA时仍维持缓解,这29例患者的随访时间均接近1年。
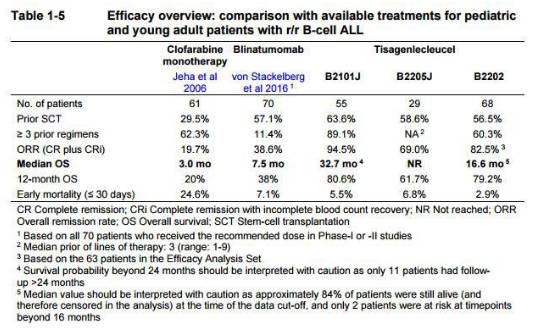
*来自诺华公开数据
*来自FDA官方数据
4.请注意以上数据的病例数
你觉得是不是和你以往做的病例数相差巨大呢?复发率控制得很好,应答率很高,仔细去想想他的临床方案以及入组条件,包括了PD-1的联合使用。病例数并不算多,但这毕竟是突破性疗法,而且入组条件严格。
5.如果这次专家委员会举手通过了,接下去FDA会关注什么?
它是一个体外提取T细胞,然后基因层面修饰的技术,再次回输。这类似于给一个病人定制一种药品。抽取这个病人血液,提取T细胞,然后改造一下基因,让该T细胞变异,类似于从普通士兵变成了蜘蛛侠,而且是培养出很多蜘蛛侠,然后回输到体内,专门识别、打击肿瘤细胞。
所以里的几个问题显而易见:
体外过程质量控制必须非常严格
;
如果普通人变异成蜘蛛侠的过程中出了一点小状况,也或者有那么几个蜘蛛侠其实是失明的,表面上看不出什么,可是到了体内发生了识别不精准的情况,他也可能攻击好人;也许蜘蛛侠挺好的,可是越养越多,到了体内,蜘蛛侠一代不如一代……最后还是肿瘤细胞获胜了……我们技术想了很多方法去控制,普遍认为技术已经到第四代。
也就是说,给蜘蛛侠加一个开关,当大量蜘蛛侠进入体内的时候,并不具有战斗力,必须外用一些药物,激活他们,这是防止他们进入体内只有肆意攻击,找不准目标,一旦外界药物停止,蜘蛛侠们很快就失去能源,这是防止他们一旦被激活就肆无忌惮,所谓现在的技术不仅仅希望能制造出蜘蛛侠,还希望能控制他们何时进攻何时消亡。所以生产控制也许是一个挑战。还有让所有人记忆犹新的细胞因子释放综合征……长期毒性和长期安全性,恐怕需要很长一段时间的收集整理。














