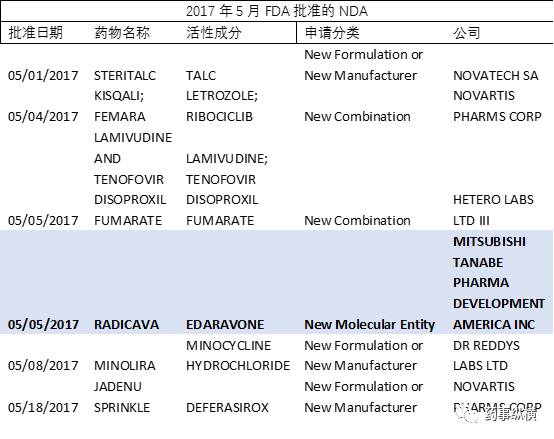
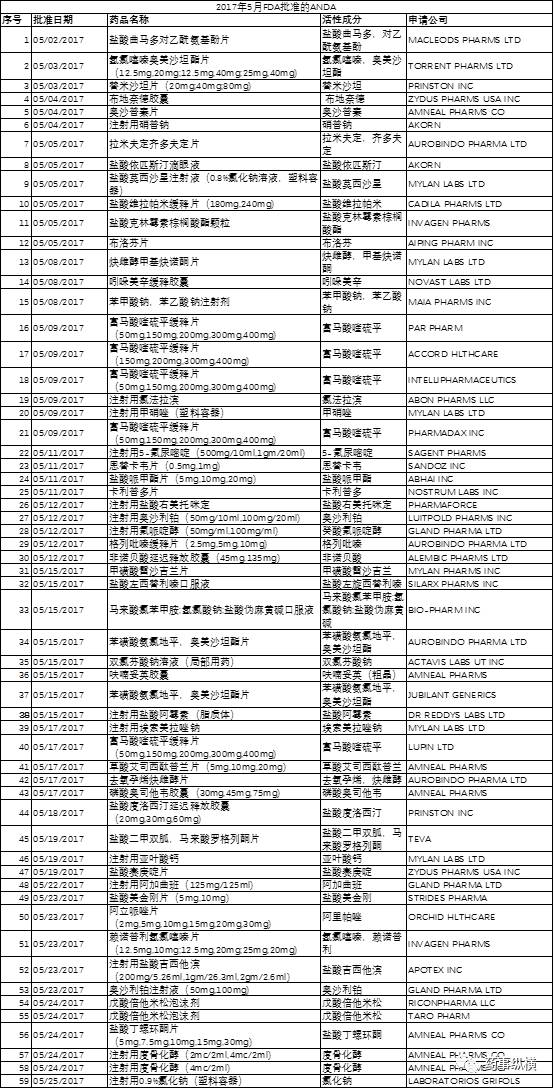
据 FDA 官方网站显示,2017 年 5 月 FDA 共批准了 6 个新药申请(NDA),其中包括 1 个新分子单体(NME);59 个仿制药申请(ANDA)。以下是批准详情。

本月第一天,阿斯利康研发 PD-L1 的人源单克隆抗体即获得 FDA 加速批准,此次批准 Limfinzi 用于治疗局部晚期或转移性尿路上皮癌,适用于以含铂类药物化疗或化疗后疾病进展的患者,或术前术后以含铂类药物化疗的 12 个月内疾病进展的患者。
据悉此次批准基于 1/2 期研究的数据:所有可评价患者的客观缓解率为 17.0%,在所有可评价患者中,大约有 14.3% 的人达到部分缓解,有 2.7% 的人达到完全缓解。而在肿瘤表达高水平 PD-L1 的患者中,客观缓解率为 26.3%。
今年 3 月 23 日,FDA 已批准 Bavencio 用于 12 岁及以上儿童和承认转移性默克尔细胞癌(mMCC)。作为全球首个获批治疗治疗 Mmcc 的 PD-1/PD-L1,免疫疗法,同时也是继 Tecentriq 之后全球获批的第二个PD-L1免疫疗法,药事纵横此前有过报道。
5月9日,Bavencio 获得 FDA 批准增加新的适应症,与 5 月1日批准的 Imfinzi 一致,均适用于局部晚期或转移性尿路上皮癌的治疗。此次 FDA 批准 Bavencio 治疗局部晚期或转移性尿路上皮癌(mUC)基于一项开放、单组、多中心的 I 期临床研究。
作为当前备受瞩目的一类肿瘤疗法,PD-1/PD-L1 免疫疗法旨在利用人体自身的免疫系统抵御癌症,通过阻断 PD-1/PD-L1 信号通路使癌细胞死亡,具有治疗多种类型肿瘤的潜力,有望实质性改善患者总生存期(OS)。据相关数据,PD-1/PD-L1市场峰值高达 350 亿美元。
今年 2 月 1 日赛诺菲与合生元合作开发的靶向 1L-6R 单抗 Kevzara(sarilumab)获得加拿大卫生部批准,成为继罗氏 Actemra 之后全球第二个上市的 1L-6R 单抗,用于对一种或多种生物制品或非生物制品疾病调节性抗风湿药物(DMARDs)不充分响应或不耐受的中重度活动性类风湿性关节炎成人患者。
5月22日,FDA 批准 Kevzara 的申请。Kevzara 是一种人源化单克隆抗体,能够抑制白介素-6受体介导的炎性信号,可作为单药治疗,也可与甲氨蝶呤(MTX)或其他传统的 DMARDs 药物联合用药。
此次批准基于在大约 2900 例对既往治疗方案缓解不足的中度至重度活动性 RA 成人患者中开展的临床研究数据。在 2 个关键性 III期临床研究中,Kevzara 联合 DMARDs 使患者的 RA 症状和体征实现了统计学显著和临床意义的改善。
5月5日,FDA 批准了 MT Pharma America 研发的 Radicava(edaravone)上市,用于治疗肌萎缩性侧索硬化(ALS)。这是美国 FDA 22 年来批准的首款 ALS 疗法。Radicava 是一款神经保护剂,使神经免于氧化应激和神经元凋亡。此前,Radicave已于日本上市,并获 FDA 颁发的孤儿药资格。
作为一种罕见的渐进性神经退行性疾病,ALS 俗称渐冻人症,此前广受关注的冰桶挑战即是唤起关注 ALS 的慈善活动。由于这种疾病的渐进性特性,患者的症状会不断恶化。据估计,大部分患者会在症状首次出现的 3-5 年内由于呼吸衰竭而死亡。
此次批准基于一项于日本进行的为期 6 个月的临床试验。137 例 ALS 患者随机接受 Radicava 或安慰剂治疗。数据显示,与安慰剂相比,接受 Radicava 治疗 6 个月的患者,身体功能下降显著减少——33% 或 2.49 ALSFRS-R 得分(p=0.0013)。
本月 FDA 共批准了 59 个仿制药申请(ANDA),文末附上批准列表。其中, 富马酸喹硫平缓释片有5家申请,其中4家申请规格为:50mg,150mg,200mg,300mg,400mg。戊酸倍他米松泡沫剂、苯磺酸氨氯地平奥美沙坦酯片和注射用度骨化醇均有2家企业申请。
以下是批准详情(点击可看大图)。
声明:本文由药事纵横编辑整理,如有错漏,感谢您的指正。
本文转自药事纵横,转发本文仅为学习与交流,如有版权问题,请联系小编删除。
















