处方前研究的目的是提供处方工艺设计的依据,并对处方工艺研究中出现的问题提供机理明确的针对性的解决方案。
处方前研究的主要内容是搞清楚原料药和辅料的理化,生物学,和机械性质。
处方前研究还需要与制剂研究相结合,由此确定原料药的关键属性CQA:原料药性质对制剂的影响既是制剂研究的工作,也是处方前研究的工作 。
m.p., pKa , logD
CHEMICAL AND PHYSICAL STABILITY
PARTICLE SIZE, SURFACE AREA, AND DENSITY
MECHANICAL PROPERTIES:
PLASTICITY, ELASTICITY,
COMPRESSIBILITY, FLOWABILITY考察的项目需要考虑一般性质和与该原料和制剂相关的性质。
仿制药的晶型选择:理解原研药的晶型(物理状态)的选择原则结构有序程度:最稳态结晶 = 亚稳态结晶>液晶>无定型
能量的差别决定了物理态的溶解度和稳定性:势能越高,溶解度越高,而稳定性越差.。
溶解度 : 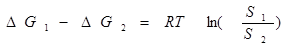
稳定性: 高自由能的状态将自发转化为低自由能状态,只是动力学速率有快慢之分。
现有的指导原则包括:
Guidance for Industry, ANDAs: Pharmaceutical Solid Polymorphism; July 2007;
ICH Q6A Guideline;
Guidance for Industry, Regulatory Classification of Pharmaceutical Co-Crystals, Apr 2013
案例一:稳定性下降,杂质超标;
案例二:密度下降,导致片剂尺寸超出FDA指导原则的要求,对高载药量的产品特别需要注意。四类溶解度信息:
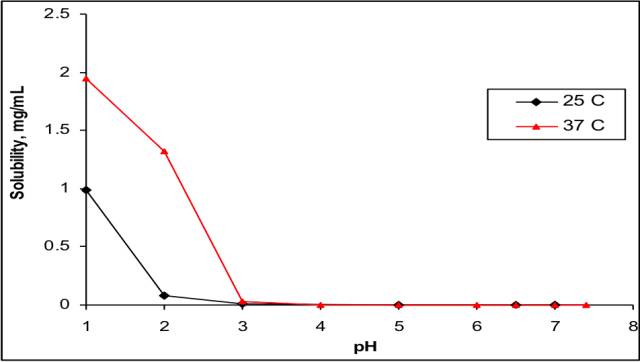
pH-溶解度
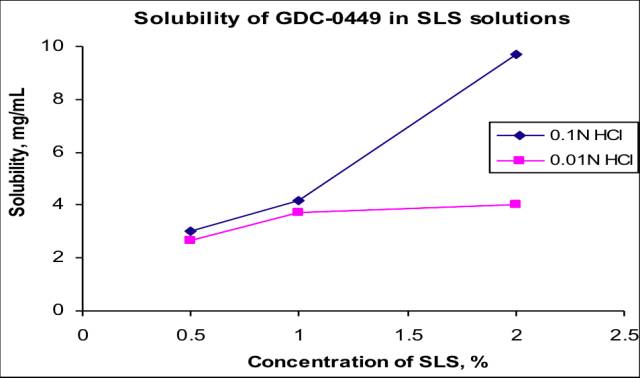
溶出介质中溶解度
API为强酸弱碱盐
pKa:2.3
BCS分类:II类,低溶高渗
API溶解度受pH影响极大,在3.5以上几乎为零
问题:片剂溶出度较原研低,调整处方工艺后仍不能完全解决。
检查API的性质
通常这类pH-溶解度急剧下降的药物同时存在与PPI共用的吸收问题,通过文献检索可以发现;
国内API的pH在质标限度边缘的情况并不少见,常与制剂的溶出度和稳定性问题有关,制剂开发时需要特别注意。
API为强酸弱碱盐
pka:3.8
BCS分类:II类,低溶高渗
含有SLS 的处方比去除SLS的处方溶出更慢;
原料药的十二烷基磺酸盐溶解度降低;
措施:处方中弃用SLS
API溶解度较高,溶出条件远超Sink condition,为什么溶出不完全?
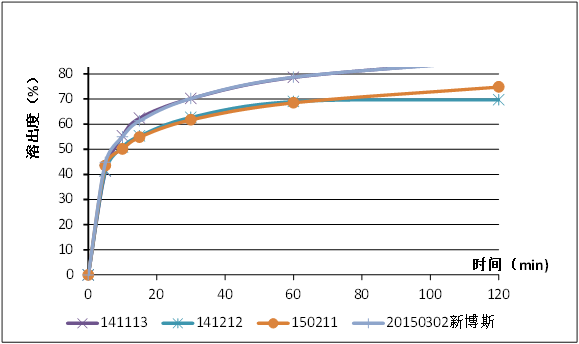
检查:原辅料相容性
该盐在酸中溶解,而原研的溶出度测定介质是0.1N HCl,因而原研没有发现;
上述2,3两个案例可见,稳定性试验中溶出度下降或漏槽条件下溶出不完全往往预示API成盐状态发生变化,可能由原辅料相互作用引起;
通常原辅料相容性试验往往不考察成盐和物理状态的变化,不容易发现此类相互作用
对仿制药来说,由于一致性的要求,一般优先考虑与原研相同的增溶手段
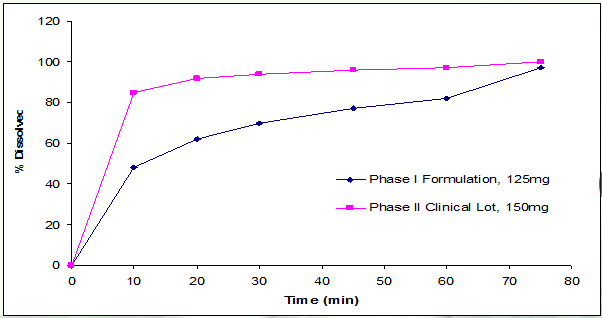
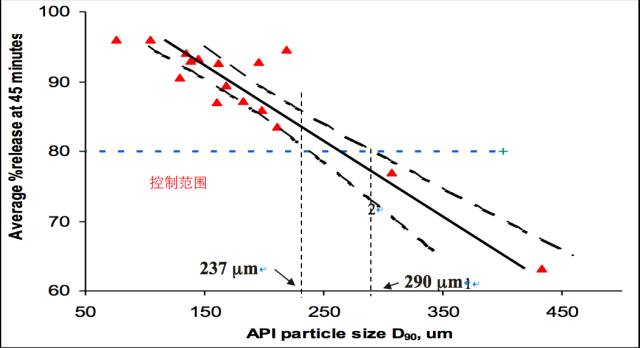
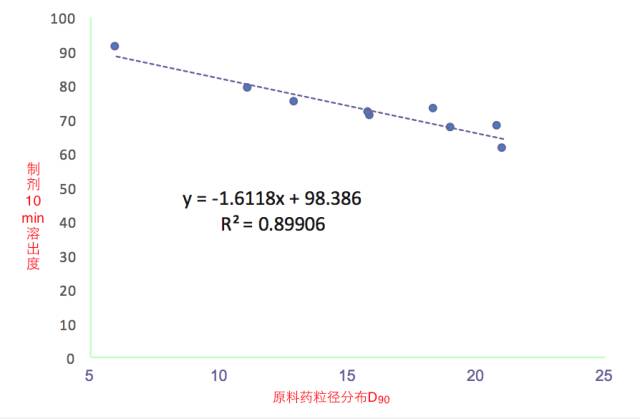
案例2 某速释片剂
采用类似的回归分析的办法确定粒径控制范围;
得到粒径控制范围为12-15um;
在粒径控制范围很窄的情况下特别适用。
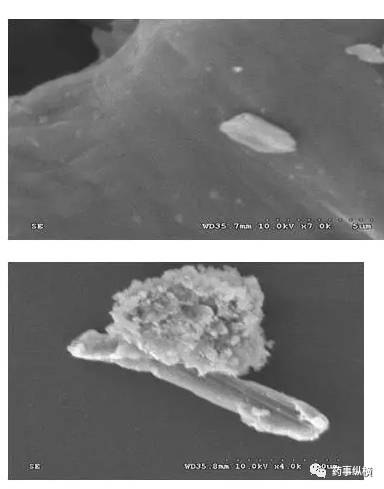
可否用显微分析得到原研制剂的粒径?
显微分析得到的粒径数据与光散射不同,数值不能直接转移;
当API结晶为针状片状时,显微观察难以确定粒径大小;
粒径表达为大量颗粒的分布情况,显微观察原研制剂往往难以避开辅料的干扰准确测量大量颗粒;

粒径和溶出是否要分别独立控制?例如文献报导了原研的粒径范围,是否溶出和粒径都需要与原研一致?
处方前的研究内容:
原料药的化学结构和活性基团;
降解机理,途径,和产物:水解,氧化,聚合,光解等;
稳定性影响因素(强制降解实验):pH、水分、温度、光照等;对pH不稳定的药物需要研究pH-stability曲线以确定最稳定范围;
稳定性影响因素研究的结果为处方工艺包材的选择,以及制剂研发中出现的质量问题提供机理性的解决方案。
文献1: 苯磺酸氨氯地平片的制备工艺研究,郑敏 - 《内蒙古医学杂志》,2012, 44(9)
【摘要】:…处方为:苯磺酸氨氯地平6.93g、微晶纤维素80g、乳糖80g、低取代羟丙基纤维素(L-HPC)9g、5%淀粉浆适量、硬脂酸镁1.5g。制备工艺为:将处方中的原辅料皆粉碎过80目筛,称取处方量的苯磺酸氨氯地平、微晶纤维素、乳糖、低取代羟丙基纤维素,先将除苯磺酸氨氯地平及硬脂酸镁外的其它辅料混匀,按照等量递增法将苯磺酸氨氯地平与混合好的辅料混匀,加5%淀粉浆制成软材,过20目筛制粒,50~60℃烘干,18目筛整粒,加硬脂酸镁,混合均匀,测颗粒含量,计算片重,7.5mm浅凹冲压片,即得结论:本品处方设计合理,工艺稳定可行。
文献2: HPLC法检测苯磺酸氨氯地平片剂中的乳糖相关杂质,吴暎 刘伟 林萍 –《药学进展》 2013年02期
【摘要】:…结论:该法可用于测定苯磺酸氨氯地平片剂中的乳糖相关杂质含量…【正文快照】: 苯磺酸氨氯地平为…在苯磺酸氨氯地平片剂的处方研究中,笔者发现制剂中有一种随着放置时间延长而含量明显增加的杂质(命名为杂质Ⅰ,2), 而苯磺酸氨氯地平原料在同等条件下无此杂质…
点评:
氨醛缩合(Millard reaction)反应是制剂处方中较常见的相容性问题;
对药物的结构和活性集团不够重视,处方设计的时候没有考虑
文献1:兰索拉唑肠溶片稳定性和溶出度的影响因素研究 ,王贺,孙备,李姜晖,刘羽(安徽省药物研究所),中国药业,2010,19(14),32结果显示:在40℃条件下,PH3.7的冻干样品比PH3.0和PH4.5的冻干样品品稳定性好,杂质增长小;结论:确定产品质量标准中PH值范围在3.0-4.5。点评:

本文整理自崔勇博士在同写意第44期论坛上的报告“仿制药开发中的制剂处方前研究”。
本文来源微信公众号 同写意,转载仅为学习交流,点击阅读即可阅读原文。如转载中无意侵犯到版权,请联系小编删除。

药事纵横是一个开放,由自愿者组成的团体,现有成员10名,分别为Voyager88,雷诺岛,三分话,Herman,Mzwinsunny,文竹,靓哥,巉巉之石,蓝色枫叶,ISAL,欢迎有志之士加入我们团队。投稿、加专业微信群【合成、制剂、分析、注册、BD、一致性评价】请加微信442015666,QQ群:22711855/22711679(限加一个)













