正文
▎药明
康德/报道
Kite Pharma与诺华(Novartis)公司靶向CD-19抗原的CAR-T细胞疗法已经进入了FDA审批的最后阶段,它们有望成为在2017年
第一批
被FDA批准的CAR-T细胞疗法。近日,这两家公司同时在欧洲血液学协会(European Hematology Association)第22届年会上发布了各自疗法的最新临床试验数据分析结果。

Kite Pharma公布是使用axicabtagene ciloleucel (axi-cel, KTE-C19)治疗
难治性,侵袭性非霍奇金淋巴瘤(NHL)
的多中心临床2期试验结果。Axi-cel已于今年5月获得了FDA颁发的
优先审评资格
。在名为ZUMA-1的临床试验中,101名患有弥漫性大B细胞淋巴瘤(DLBCL),原发性纵隔B细胞淋巴瘤(PMBCL)或转化滤泡淋巴瘤(transformed follicular lymphoma)的患者接受了剂量为2X10
6
细胞/公斤体重的axi-cel治疗。这些患者的肿瘤都属于难治性或复发性肿瘤。ZUMA-1试验
达到了它的主要终点
:在调整的意向治疗人群(modified intent-to-treat population) 中的
客观缓解率(ORR) 达到82%
,其中
完全缓解率(CR) 达到54%
。患者的临床肿瘤亚型、难治程度、肿瘤级别以及淋巴瘤国际预后指数(International Prognostic Index)等重要变量并没有对他们的临床反应产生显著影响。Axi-cel达到的CR水平比历史上的对照组CR水平
高出7倍
。而且在平均为期8.7个月的跟踪调查中,大约有一半的患者仍然保持有临床反应。

诺华公司公布的是使用CTL019治疗
复发性或难治性DLBCL患者
的开放标签,多中心临床2期试验的中期分析结果。CTL019已于今年3月获得了FDA颁发的
优先审评资格
,4月又获得了FDA颁发的
突破性疗法认定
。在名为JULIET的临床试验中,位于10个国家的85名患者接受了一次CTL019治疗。这些患者的肿瘤在已经接受过至少两种不同疗法后仍然复发或恶化,而且他们不适合使用干细胞移植疗法。JULIET临床试验也
达到了它的主要终点
。在51名跟踪调查时间超过3个月或提前结束试验的患者中,
最佳总缓解率(best overall response rate) 达到59%
, 其中包括
43%的CR和16%的部分缓解(PR)
。所有达到完全缓解的患者在数据截止时仍然处于完全缓解状态。
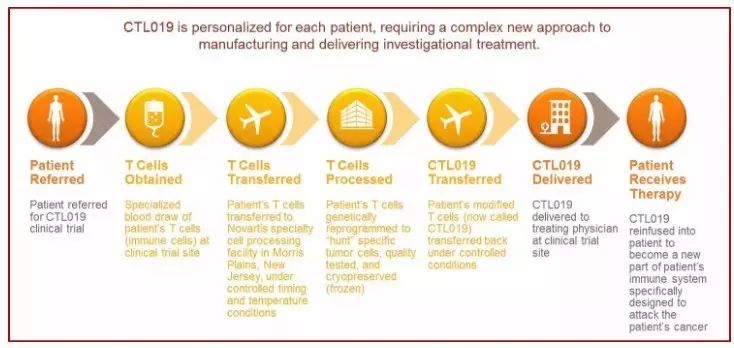
▲
CTL019的治疗流程(图片来源:诺华官网)
CAR-T细胞疗法的
副作用
也是值得关注的临床数据。在这方面,axi-cel导致3级或3级以上细胞因子释放综合征(cytokine release syndrome, CRS)的患者比例为13%, 而CTL019为26%。Axi-cel导致3级或3级以上神经系统不良事件的患者比例为28%,而CTL019为13%。














