
2017年7月17日,基石药业宣布全人源PD-L1抗体CS1001获得国家食品药品监督管理总局办法的临床试验批件。
CS1001研发历程
CS1001为全人源的PD-L1抗体,由药明康德研发。
2012年9月、2013年3月,药明康德与OMT公司先后两次签订合作协议,获得后者授权利用其转基因动物抗体药物筛选技术平台OmniRat、OmniMouse,并获得授权将其技术平台复制转移到中国。药明生物利用该技术平台先后筛选了PD-1抗体、PD-L1抗体,分别卖给誉衡药业、基石药业;
2016年4月,誉衡药业PD-1抗体GLS-010提交临床申请;
2016年7月,基石药业PD-L1抗体WBP3155提交临床申请(现在研发代码改为CS1001);
2016年7月,基石药业完成1.5亿美元A轮融资,由博裕资本、元禾原点、毓承资本(药明康德旗下风险投资基金)共同参与;
2016年8月,药明生物申请PD-L1抗体专利,誉衡药业申请PD-1抗体专利,发明人均为药明生物的郑勇、李竞、陈智胜;
2017年7月,基石药业PD-L1抗体CS1001获批临床。
CS1001结构特点
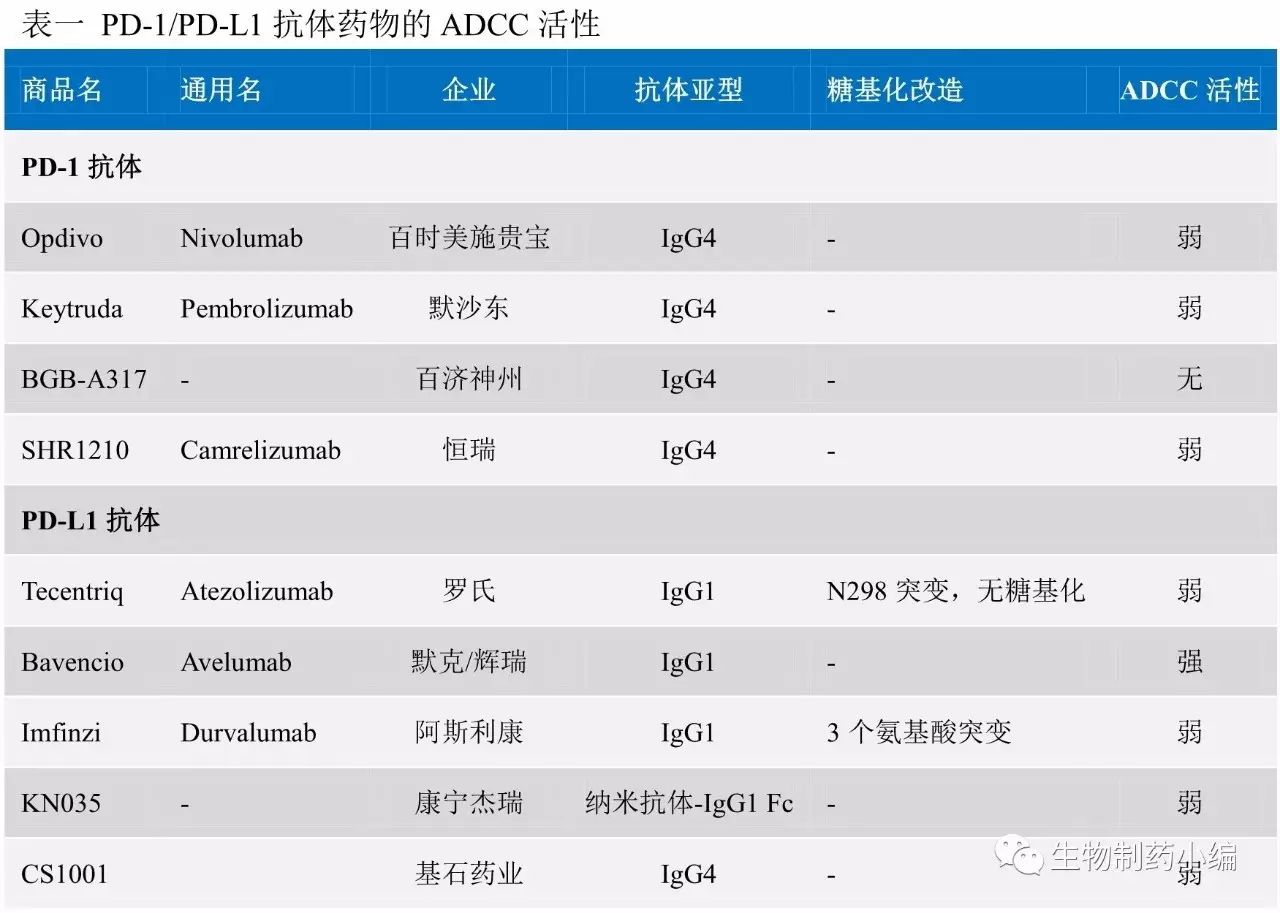
截至目前,FDA已经批准了2个PD-1抗体、3个PD-L1抗体,多数采用弱ADCC设计,仅辉瑞/默克联合开发的Avelumab采用强ADCC设计。罗氏与阿斯利康的PD-L1抗体均采用IgG1亚型,罗氏Atezolizumab通过糖基化位点氨基酸突变突出ADCC活性,阿斯利康Durvalumab通过3个氨基酸突变弱化ADCC作用。药明生物直接采用弱ADCC活性的IgG4亚型。
CS1001此前的研发代码为WBP3155,根据对药明生物PD-L1抗体专利的分析,初步判断其克隆号为1.14.4:转基因鼠筛选的全人源抗体,采用IgG4亚型,轻链采用lambda链。具体序列如下(由于专利中未给出恒定区序列,此处给出IgG4 恒定区初始序列,理论上Fc仍需进行必要突变如S228P,避免Fab exchange):

▲ CS1001氨基酸序列,红色部分为CDR1、CDR2、CDR3
小编总结
近年来PD-1/PD-L1抗体领域大热,国内药企纷纷加入这一领域的竞争。在激烈的竞争格局下,差异化设计成为后来者获得竞争空间的重要策略:百济神州完全去除IgG4亚型的Fc effector效应,与新基签订数十亿元的合作协议;康宁杰瑞采用独特的纳米抗体-Fc融合蛋白结构,制成稳定制剂,已经获得日本批准临床研究。
誉衡药业PD-1抗体、基石药业PD-L1抗体案例反映了CRO企业在国内生物制药行业的角色发生深刻转变。药明康德向上拓展到抗体药物研发,向下拓展到生产,覆盖了生物药新药尤其是抗体药物研发生产的全流程。誉衡PD-1抗体、基石药业PD-L1抗体即是典型的全流程打包服务。此外,药明康德通过直接投资药企(如基石药业)或者合作(如细胞疗法的药明巨诺),越来越深入的参与新药研发竞争。
扩展阅读
参考资料
欢迎加入小编团队成为小编一员
请加小编微信号:wuwenjun7237
如有技术解读、行业洞见愿意分享
欢迎投稿到小编邮箱:[email protected]

版权为生物制药小编所有。欢迎个人转发分享。其他任何媒体、网站如需转载或引用本网版权所有内容须获得授权且在醒目位置处注明“转自:生物制药小编”。

坚持原创、坚持专业
欢迎关注生物制药小编
投稿信箱:[email protected]
小编团队现有13位成员:
Armstrong、医药局外人、Fairy、Jone、
东胜西牛、Alpharesearcher、MT、百草、
Irene、北望、蛋白工人、At.Zhou、Julia
欢迎有共同兴趣的朋友加入













