上周,CFDA连续发布4个征求意见稿,直指改革深水区,在海内外业界引起了一阵骚动。这4个征求意见稿有太多的亮点,
比如完善药品试验数据保护制度,引入数据保护期的概念(暗含着监测期的概念退出历史舞台);比如临床试验默认60个工作日审批(或查)时限;比如临床试验先伦理批准,再药监审批(查)
,等等,每个亮点都能写出一篇文章。小编这篇文章关注的是“
接受境外临床试验数据
”这个亮点,如何接受境外临床试验数据?它由什么样的科学和监管理念支撑?国际多中心临床试验(MRCT)有什么作用?小编班门弄斧,欢迎大家共同探讨。
历史永远是当下最好的借鉴,我们先来看看世界制药业发达的地区和组织是怎样接受境外临床数据和怎样运用国际多中心临床试验的。
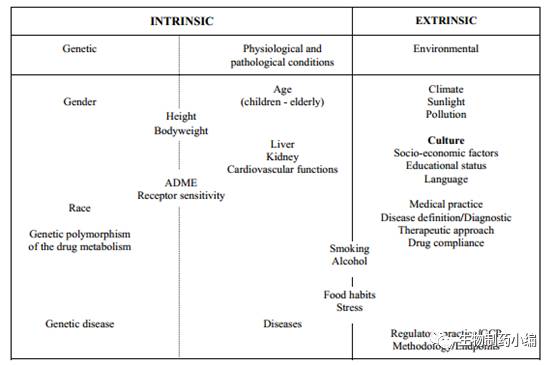
ICH E5是开山鼻祖,在1998年就发布了正式的指南,指导业界如何接受境外临床试验数据。对于制药企业来说,在一个国家/地区已经进行过全套的临床试验,他们是很希望在另一个国家/地区申请上市时,不再重复这些试验,重复是对于资金和时间的浪费;对于患者来说,重复的临床试验会造成他们晚于其他国家/地区用上最新的有效药物;对于药监当局,他们也不希望浪费社会资源,但他们对于使用境外的临床数据又有些担心,这是因为人种的原因(ethnic differences,见下图),不同的人种可能对同一种药物有不同的反应剂量,不同的安全性特征等等。于是ICH给出了两点建议,评价这两点就可以大致判断是否可以使用境外数据用于境内审批:
图一. 治疗性抗体技术的演变和临床进展
-
已有的临床试验数据是否满足当地的注册要求
-
境外临床数据外推到当地人口使用情况的能力
对于第一点,其实可以看作是当地的硬性或行政要求,在征求意见稿里也反复出现“符合中国药品注册要求的”才可以怎样。结合实际来看,目前现行的《注册管理办法(28号令)》附件2有说明,如果是创新药要做I、II、III期临床试验,其中规定I期为20至30例,II期为100例,III期为300例。也就是说,如果注册管理办法不变,符合中国药品注册要求的境外创新药临床试验意味着要包括这么多中国病例(注:在去年的《注册管理办法修订稿》和《化学药品新注册分类申报资料要求(试行)》中都没有像现行注册管理办法这样明确的病例数要求)。这条改革的亮点在于如果国际多中心临床试验满足中国注册要求就可以直接报产,而不是之前饱受诟病的三报三批,其实国内早就接受国际多中心临床数据,只是申报程序让人望而却步。
那如何判断境外临床数据的外推能力呢?ICH E5引入了桥试验(Bridge Study)的概念。桥试验是指在当地做一个补充试验(可以是PK/PD,也可以是安全性或有效性试验),这个试验建立起了当地病例和境外病例的桥梁,有了它,就有可能不用做全套的临床试验,而是用国外的试验数据外推到当地,这样就大大节约了在当地的时间和资金成本(注:桥试验概念应用很广,比如化药的上市后重大变更如场地变更,就可以利用BE这个桥试验来证明变更前后对产品没有大的影响)。
在2006年发布的E5 Q&A中,ICH又说明了桥试验是国际多中心临床试验时的情况,这种情况发生在全球同步注册的背景下。离我们很近的日本在2007年发布过更加详细的指导意见说明这个情况。
日本也出现过国外批了很久的药,在国内用不上的情况,而且在当时愈演愈烈。于是日本药政当局也如现在的中国发布了接受国际临床试验的基本原则这样的指南。这份指南意在促进鼓励日本加入药物研发的早期阶段,从而实现跟国外同步上市新药的目的。它特别指出桥试验的概念不仅适用于境外数据外推到日本的情况,也适用于全球临床试验(global clinical trial)的同步开发。它推荐最迟在剂量发现的临床试验中(即I期临床试验)就要加入到全球临床试验。另外,原则中也指出,如果某些特殊情况合理(如某些医疗实践和科学因素),也可以在从III期临床试验进入全球研发计划,但需要在密切监控的条件下进行。
这条明显有利于外资企业的政策实实在在地引“狼”入室,内资企业怎么办呢?热映的印度影片《摔跤吧!爸爸》在比赛的段落里有拍到:跟第一个对手采取攻的策略,跟第二个对手采取守的策略,跟第三个对手用的不是策略,而是情怀。在境外企业在政策利好的情况下大举进华的背景下,境内企业离国际多中心试验有多远,代表着这个企业是怎样的策略,更进一步是其内在的品格和文化,还有底气。征求意见稿这条的第一句话是“申请人在境外取得的临床试验数据,符合中国药品医疗器械注册相关要求的,经现场检查后可用于在中国申报注册申请”,那我们有没有能力走出国门,用自己的境外数据反哺国内?我们很有幸经历和见证这样的历史。
参考资料
1. ICHE5
2. ICHE5 Q & A
3. PMDA:Basic principles on Global Clinical Trials
欢迎加入小编团队成为小编一员
请加小编微信号:wuwenjun7237
如有技术解读、行业洞见愿意分享
欢迎投稿到小编邮箱:
[email protected]

版权为生物制药小编所有。欢迎个人转发分享。其他任何媒体、网站如需转载或引用本网版权所有内容须获得授权且在醒目位置处注明“转自:生物制药小编”。

坚持原创、坚持专业














