作者 l 游方和尚
编辑 l 细胞房间
本文为探讨如何判定药物毒理研究中的不良和非不良效应的系列文章的第三篇,本系列的前两篇探讨了在临床前动物的毒理研究中如何判别药物引起的不良效应。本文将在此基础上,更深入地探讨有关如何准确定义和理解何为不良效应和非不良效应,如何确定NOAEL,以及其它相关问题。本文根据已发表的文献资料和小编之前的相关文章做出的一个简介。希望起到抛砖引玉的目的,引发更多的相关讨论,交流和研究。
导论
在开发的新药进入首次临床试验之前,确定人体安全起始剂量是最重要的步骤之一。FDA的相关指南的重点放在了临床前毒理学研究中用药剂量的未观察到不良效应水平(NOAEL)上。然后通过应用适当的比例因子,将NOAEL转换为人体等效剂量(HED)。确定HED后,需要更进一步使用适当的安全系数降低剂量从而得出最大推荐起始剂量(MRSD),以保证起始剂量不会对人体造成毒性。
为了预测人体的安全暴露量,有必要描述观察到药物毒性的边界,即首次观察到不良效应的最低剂量(LOAEL)或未发现不良反应的最高剂量(NOAEL)。为了确定LOAEL 和NOAEL,就必须评估在研新药内在的毒理学特性。
需要强调的是,一般情况下,关注和评估单个毒理研究可以简化评估过程,这里的主要目的是为确定哪些药物引起的效应(与基线值的差异)是与药物相关,以及其中与哪些药物相关的效应被视为不良。然而,在实践中,对不良效应引起的危害的评估经常要考虑来自一系列研究的数据(来自不同的物种和研究类型),进行一个综合评估。因此,最终结果反映了所有证据的总体量。
该评估过程通常包括2个步骤:首先,区分治疗组与对照组之间在治疗相关效应上的随机差异;其次,应区分不良效应和非不良效应。在每个步骤中,都需要有在作出判断时应考虑的区别标准和因素。
详细内容请见扩展阅读。
如前所述,鉴别和区分不良和非不良效应的最终目的是确定NOAEL。那么究竟该如何定义“不良效应”以及NOAEL呢?这个问题本身并不简单。本文就如何定义不良效应以及确定NOAEL介绍现行的思考与实践。
相关定义
下述定义将作为本文讨论的起点。 随后对这些已在使用中的定义作进一步的阐述,以期能加深对它们的理解,并有助于对人体风险的评估。
不良效应(Adverse effect)
- 单一或组合的生化,形态或生理变化(对外来刺激的响应),对整个生物体的性能产生不良影响或降低生物体对其他环境挑战作出反应的能力。
非不良效应(Non-adverse effect)
- 不会引起影响动物的总体健康,生长,发育或寿命的生化,形态或生理变化的那些生物效应。
适应性反应(Adaptive response)
- 属于非不良效应的一类,在毒理学的背景下, 细胞或生物体对暴露于异体物质的情况下作出的反应, 使得细胞或生物体能够在包含异体物质的新环境中存活而其功能不受损害。
生物学上显著的效应(Biologically significant effect)
- 生物体或其他生物系统中对生物系统健康具有实质性或显著性(正面或负面)的,对外来刺激的响应。该概念应该与统计上显著的影响或变化区分开来,这些统计上显著的影响或变化对生物系统的一般健康状况可能有意义或可能没有意义。
未观察到效应水平(NOEL)
-与适当的对照相比较,在暴露的群体中没有观察到任何效应(不良或非不良)的最高暴露量水平。
未观察到不良效应水平(NOAEL)
-暴露群体与其适当对照之间,不良效应的频率或严重程度没有统计学或生物学意义上显著性增加的最高暴露水平。在这个水平上可能产生一些影响,但它们不被认为是不良影响或不良影响的前兆。
观察到不良效应最低水平(LOAEL)
-暴露人群与其适当对照之间不良效应的频率或严重程度存在统计学或生物学意义上的显著性增加的最低暴露水平。
文献中的定义的不良效应与非不良效应
自1940年以来, 非临床毒性研究方面产生了许多技术改进。21世纪以来,非临床毒性研究在动物健康和福利、研究设计和分析方法、质量控制、病理和毒理学实验技术和数据解释,质量控制,科学同行评审和详细报告,等,各方面都取得了高质量的成就。尽管拥有这些技术进步, 但个别测试药物对动物产生的有害影响与在人体上产生的不良效应之间仍然存在相当大的差异(Greaves, Williams, and Eve 2004; Olson et al. 2000)。这种差异突显了现代风险评估技术和方法在本质上的某些局限性。
目前,在动物毒性研究中广泛采用的风险评估方法是确定未观察到不良效应水平(NOAEL)的方法。 NOAEL常用于预测人类会接触到的新材料(生物/医药制剂、农业和大宗化学品、食品添加剂,等)的安全性。通常,NOAEL被认为是在某个特定研究中经过实验研究确定的剂量(或暴露水平),在这个剂量或暴露水平上,被测试药品不会引起任何不良效应(即解剖学、生化或功能上有害的结果) 。为了评估人类面临的潜在风险, 我们常常利用一项或多项多剂量的动物研究确定不会产生有害(即不良)影响的最高水平。另一方面,毫无差别地使用由动物实验产生的NOAEL也会造成困难, 因为它过度简化了对人体潜在风险的估计。
下面简要地回顾展示过去十多年来用来识别不良效应的各种不同方法和解释。这是因为只有在最大限度地减少以前在界定和应用不良效应概念方面的困难的情况下, 才能改善各利益相关方之间有关不良效应水平和NOAEL的沟通。
不良效应
不良效应的定义可以在许多法律、条例和科学文献中找到(BfR, 2009; Boekelheide and Andersen, 2010;Dorato and Engelhardt, 2005; Goodman et al., 2010; JMPR, 2006; Lewis et al.,2002; NRC, 2007; USEPA, 2009)。有一份旨在比较和对比 "不良效应" 定义的汇编(表1; Krewski 等, 2010)。这个汇编突出了当试图定义和使用 "不良效应" 一词时可能遇到困难。
表1. 不良效应的若干定义

在最近的文献中,不良效应的定义(Hall et al, 2012; Keller et al,2012)是根据21世纪初发表的一些定义建立起来的。这些定义承认多个生理参数可能会受到被测试物的影响。其一被定义为:
“...... 生化、形态或生理变化(作为对刺激的反应),单独或一起对整个生物个体的性能产生不良效应,或降低生物个体对进一步环境变化的反应能力。”(Lewis 等, 2002)
这个定义的一个缺点是,在试图定义 "不良" 时使用了 "不良效应" 一词, 这使得定义是循环的, 因此无法使用。同时,这一定义使用了高层次的抽象的概念(例如,福祉well-being),没有提供足够的细节,以供毒理学家和病理学家对个别发现的不良性进行实际评估。
在另一种情况下,不良效应被定义为:
.. 生物个体、系统或(亚)群体的形态、生理、生长、发育、生殖或寿命的变化, 导致功能的性能受损,补偿进一步压力的能力受损,或增加对其他影响的易感性。(国际化学品安全方案,2004年)
这种方法被批评为过分强调"顶端响应",即在生物体中观察到的与某些化合物接触后的相关的整体影响;这种顶端结果的例子包括临床体征或病理状态(即 "病变"),表明是有毒物质引起的病变。(Krewski et al, 2010)
从全面的,跨学科的角度来看,不良效应可以在分子(如DNA损伤、受体相互作用、加合物)、细胞(如单细胞坏死、细胞增殖、肥大)、组织(如全厚度皮肤坏死、炎症、纤维化)、或生物个体整体(如休克、死亡)的层次上加以考虑。
在标准的毒理学研究中,病理学家主要根据细胞、组织或器官水平的形态学终点(morphologic end points),结合行为、生化和临床化学数据,对不良效应进行描述。
另外,在整个动物层面,行为效应也已被用于识别NOAELs和 LOAELs(如颤抖、嗜睡),但特定的形态学发现(morphologic findings)的功能性后果则往往难以评估。这是因为许多目标组织并没有明确的功能性标记物。而且,至少现在通常都无法获得有关病理效应的致病机制的信息。因此,作为判定非临床不良效应的标准,目前需要重点关注与组织病理学的变化(histopathological changes)相关的形态评估(morphological evaluation)。然而, 这并不排除在没有形态学改变(如严重贫血、行为改变、生殖效应等)的情况下识别不良效应。
目前,一般被接受的不良效应的定义是:
“细胞或机体、系统或 (亚) 群体的形态、生理、生长、发育、繁殖或寿命的变化,导致功能性的能力受损,补偿额外压力的能力受损,或增加对其他影响的易感性。”
根据这个定义,我们目前对不良效应的理解是基于所谓“顶端效应(apical response)”,这通常是一种表型反应(phenotypicresponse)。导致功能性能力受损的不良效应, 通常是由于生物体所受的伤害超过了自适应性反应的容量,而不能返回到稳态状态。其结果可能包括生物体形态、发育、寿命或生长的变化。自然,有些实验结果很容易被认为是内在的不良效应,如动物寿命的变化,死亡。然而,许多或大多数病理改变的不良效应取决于某些特定的特征,如病理变化的程度、分布、效应聚集、应对额外挑战的能力受损,以及相关的病变。这些通常不能判定为简单的,二元的,“不良”或“非不良”。
虽然在分子水平上更难定义,但潜在的不良反应应当包括基因表达、蛋白质合成或细胞调控等,方面的改变。因此,上述定义也许并不完美,因为,表型反应之锚定于基因或蛋白质表达的变化或其他体外测试的终点,对于理解生物系统的变化是否不良至关重要。而区分不良效应和非不良效应(如适应性反应)是毒理学研究的核心功能。
所有毒理学反应都应作为时间-反应和剂量-反应的连续体而加以观察和考虑。但是,早期的与低剂量/暴露量相关的毒性基因组学特征(以及其他体外或计算生物标志物,与不良的顶端终点无关) 和后期或更高剂量的毒性基因组学特征(潜在的或更经常地与不良顶端终点有关)之间往往缺乏定性上的区别。正因为如此,从非不良效应向不良效应过渡的确切节点显得十分模糊甚至任意;使用这些毒理学反应预测重大的生物影响是否有价值,似乎也值得怀疑。因此,考虑上下文(在生物体、组织和细胞的层面)和对所有毒理数据,如在其它动物种属中获取得,对于确定不良效应的关注点或出发点至关重要。
非不良效应
非不良效应的定义通常是模糊的,因为它们受到定义不良效应的许多潜在含义的影响。一些非不良效应的定义包含了被测试物引起的生物效应既可以被观察到,但又无害的概念。
例如,相对于不良效应,非不良效应可以定义为不影响受试动物的总体健康、生长、发育或寿命的生化、形态或生理变化的生物效应。(Lewis 等, 2002年)
非不良效应的另一个定义是,如果一个生物体的整体功能和寿命不会因为暴露于自外引入的化合物而改变,那么这些变化通常是被认为是非不良的。(Holsapple and Wallace 2008)。因此,在特定的毒理研究条件下,并非所有不想观察的效应都对受试动物的总体健康不利。
非不良但仍不受欢迎的受试药物的效应的例子包括:1. 在雌性(Choi等, 2011; Willson等, 2012)和肥胖的(Tvarijonaviciute,Tecles, and Ceron 2010)猎狗(beagle dogs)中,在没有其他变化的情况下,血清胆固醇浓度略有增加,这对该物种无害;2. 在啮齿类动物的过氧化物酶体功能的轻微,但被补偿的扰动(Ammerschlaeger等,2004)等。
将与受试药物引起的效应解释为非不良时,必须在更广泛的知识的范围内,解释为什么这样的效应是非不良的。在许多情况下,非不良性与一系列用于区分无害和有害(不良)影响的标准相关联。在以下情况下,药物效应可能是非不良的(
详见扩展阅读1-2
):
1. 受试生物体或受影响的器官/组织的一般功能没有改变;
2. 它是一种适应性反应;
3. 它是短暂的;
4. 它的严重程度有限,低于关注的阈值;
5. 它的效应是孤立的或独立的。通常没有观察到与所关注的效应相关的其他参数的变化;
6. 它的效应不是不良效应的前兆。这种效应已知不是随着时间的推移而发生的连续变化的一部分,而导致已知的不良效应;
7. 它是其他不良效应引起的;
8. 它与某个特定的实验/动物模型的相关。
然而,许多作者避免界定“非不良”的含义,而是允许读者通过整合讨论要点所获得的内在含义而得出自己的推断。(Dorato and Engelhardt, 2005; Hosford etal, 2004; Keller et al, 2012; Kimber and Dearman 2002)
上述第二项和第八项,即对受试药物的适应性反应和某个动物上特有的不良效应,值得特别关注。适应性反应是非不良反应的一种类型。区分不良效应和适应性反应非常重要。适应性反应一般定义如下:
适应性反应:在毒理学的意义上,细胞或生物体对异体物质作出反应的过程,以使得细胞或生物体能够在包含异体物质的新环境中存活而其功能不受损害。
接触有毒物质后的适应性反应可以表现为可逆性(在撤除与有毒物质的接触后)。此外,适应性变化往往是早期的稳态调节,如代谢或基因表达/转录的变化。这些调节通常不被认为是功能性障碍的前兆,而是一种机体的自然反应,将其状态恢复到稳态状态,即接触之前或接近接触之前的状态(例如,从激素水平变化/循环中的恢复或因压力而血压增加)。
在某些情况下,可能会持续发生微小的变化,导致 "新的正常" 状态,即细胞/组织/整体在没有不利后果的情况下进行了调整,例如诱导细胞色素 P450 酶导致肝细胞肥大和增加肝脏重量。在另外的情况下,这些适应性变化可能是潜在不良结果的指标。例如,血液甲状腺激素的短期减少可能会导致非怀孕女性的成人中的适应性反应,但早期妊娠的情况下,同样变化可能是潜在的胎儿大脑发育不良的指标。
在动物上发现的不良效应是否可以外推到人体,对于保障临床研究中受试着的安全也至关重要。一个很好的事例如下所述。临床前毒性研究表明,实验室动物在临床前安全评估时,接触肝脏酶诱导剂,会导致肝脏重量增大、肝细胞增殖,并经常在长期(或整个寿命期间) 的研究中出现肝癌。最近十年的进展表明,许多化合物可能是通过激活核激素受体 CAR、PXR 或 PPARa的相同作用机制引起上述毒理变化的。通过基因工程改造的小鼠以表达这些核激素受体的变异体,还加上通过其他渠道的研究,现在已经证明,对许多上述毒理变化效应的敏感性是啮齿类动物特有的。这些数据与现有的流行病学数据和在人体上的经验性证据一致,都支持下面这样一个观点:即这些毒理学变化与对人类的潜在危害关系不大。因此,啮齿类动物中由于肝细胞肥大造成的肝肿大,在没有组织学或临床病理改变时,被认为是非不良的适应性反应。当然,这一结论通常应该通过所有证据的综合权衡而得出。
对不良效应的总结
鉴于现有的不良效应的定义的不完美性,似有进一步讨论,完善的必要。本文在此试图抛砖引玉,综合考虑上述各个定义,拟提出一个定义"不良效应"的建议暂且如下,供讨论:
不良效应是生物个体、系统或 (亚) 群体,在外来的刺激或环境变化/影响下发生的生物化学(biochemistry),基因组(Genomic, e.g., mutagenicity andcarcinogenicity),细胞(cells),组织/器官形态(宏观和微观,tissue and/or organ morphology/anatomy-macroscopicor microscopic)、生理(physiology)、生长(growth)、发育(development)、生殖或寿命(reproduction,teratogenicity or life span)的变化, 这些变化单独地或协同地,导致生物个体的某些功能的性能受损, 其补偿进一步环境刺激/变化的能力受损, 或增加了生物个体对其他影响的易感性。功能的性能受损似乎也应包括对下一代生物体的潜在不良效应,如畸胎体发生(Teratogenesis)。
这个定义涵盖了生物个体的不同层次上的变化,提供了一系列具体的,可观测的参数,如从指示肝功能的AST,ALT增加,致基因突变和致癌,到组织、器官层面的宏观、微观的形态变化,直至生物个体整体的生理和功能性变化。从科学的角度看,所有异物,如各种化学品,药物等,都可能会有一定的“毒性”,即我们不想看到的“生物效应”。没有任何“毒性”的药物,大概率也没有“药性”,即不能治病。正所谓:是药三分毒。从实用的角度看,我们需要平衡“风险”与“收益”,即接受有限的毒性,以获取最大程度的治疗效果。临床前毒理研究也是要跟据实验所得到得数据,确定可以接受的风险。在这个意义上,少数动物的AST/ALT偏离正常范围的增加往往不作为“不良效应”处理,即便这确实代表了一部分肝细胞受损或死亡。因此,产生“不良效应”剂量水平意思是该剂量,在受影响的动物数量和受损程度上,产生了不可接受的毒性。
根据目前的不良效应的定义,判明一个药物相关的病理性质和其目标细胞/组织/器官是决定其是否是不良效应的先决条件。对于某些 "固有不良"的病变类型,只要观察到就足以判定其为不良效应。这样的例子包括死亡率、视网膜变性、恶性肿瘤、肢体畸形和神经元坏死。然而,对于大多数病理变化,其它信息也应加以考虑。根据上述定义,首要考虑是,这些药物引起的变化是否会损害细胞/组织/器官的功能或应对额外的挑战的储备能力。例如,鼻腔上皮病变只有在能够损害呼吸功能(如气道粘液)、嗅觉功能(如嗅觉上皮丧失)或清除颗粒物(如失去ciliation)的情况下,才会被称为不良效应。相反,如果不能清楚地证明其功能相关性,那么该病变就会被认为是非不良的。在许多情况下,这个决定需要关于该病变的严重程度和相关病变的信息。虽然这类评估存在固有的不确定性,但一般认为,是否是不良效应的决定最好应该是定性的,即
是
或
不是
,并不使用 "possibly"、" probably "、" likely "、等对冲术语,因为这可能会使解释不良效应进一步复杂化。
有关不良效应的定义、理解和应用,的确是一个复杂的问题,从业者需要积累多方面的知识和经验。后续将继续探讨,深化对这个概念的理解和运用。
NOAEL的定义,确定和内涵
与 "不良效应" 类似, 在将其使用的背景下界定了不良的内涵之前,NOAEL的含义仍然是模糊的。
可以使用几种方法来更好地定义NOAEL。文献中的许多定义多从统计方面对 NOAEL概念进行了界定。例如,NOAEL可以理解为:
… 此剂量所产生效应在统计学意义上与对照组之间没有区别,但与在 "最低可观察到的不良效应水平"(LOAEL) 的剂量下观察到的效应有显著差异。(Calabrese and Baldwin 1994)
或作为:
…,不导致不良效应显著增加(不具有统计意义或临床意义的,即使在统计上不显著)的最高剂量。(美国食品药品监督管理局 [FDA CDER] 2005)
NOAEL的这一定义与 "未观测到效应水平(NOEL)" 的定义不同,这意味着有一些与被测试物有关的效应;虽然在统计上不同于对照组,但可能不会对受试物种造成"伤害";并且进一步延伸为:可能并不会对人类有害。使用统计手段来定义NOAEL的吸引力在于利用数学的客观性来解释非临床数据集。然而,普遍的经验表明,一些有害的效应可能在统计上并不显著,而一些统计学上显著的变化可能不会造成伤害。因此,在确立NOAEL时,毫无疑问地依赖统计分析是不合适的。
另一种观点认为,报告不良效应可以包含统计分析,但也需要保持灵活性,因为:
…只是缺乏统计意义并不构成NOAEL的金标准,NOAEL是综合分析生物效应和统计效应而确定的。(Dorato和Engelhardt 2005)
这一观点的另一个延伸是,对不良效应的确定可以在不明确要求进行统计分析的情况下形成。在动物研究中,未导致毒性/不良效应的最高药物剂量就被称为“未观察到不良效应水平(NOAEL)”。(Muller and Milton 2012)
这种方法的另一种说法是,
未观察到不良效应水平(NOAEL)是被观察到的,没有引起对动物的福祉有害的效应的最高剂量。(Holsapple and Wallace 2008)
这些定义的优点是比严格基于统计的定义很灵活得多,因为不良效应是以经验观察来决定的。
其它定义侧重于人类风险评估,而不是对动物的影响:动物中观察到的毒性可能危及人类健康。(Dorato 和 Engelhardt2005)
最终统一NOAEL各种定义的困难在于使用这一概念想要表达的内涵。问题源于从NOAEL可能推论出的,两种截然相反的观点:NOAEL是一个通过严格的实验而确定的客观数值,还是基于可测量和不可测量因素的一个合理判断?因此,不良效应的概念,以及随之而来的NOAEL的确定,必然需要将客观和主观分析的这两个方面结合起来。根据这一观点,理解NOAEL及其在人类风险评估中的潜在效用的一个有用的视角是:在普遍意义上,NOAEL是解释被测试物质的毒理学相关的效应和预期的药理学性质的专业意见, 而且是被测试药物的毒理学性质全貌的,连续迭代的解读。(Dorato和Engelhardt 2005)
因此,作为一种 "专业意见" 被表达时,NOAEL的任何定义都将带有不同程度的主观性,其主观程度与研究人员最初对不良效应的定义和其他相关的判断有关。在简单的情况下,如死亡或严重的体重减轻,不良效应就不需要进一步阐述。然而,对于更复杂和微妙的,可能被判定为不良或非不良的效应,应明确地说明NOAEL的预期含义以及支持其数值的所有必要的理由。
对NOAEL的总结和前瞻
在小编看来,有关NOAEL是一个通过严格的实验而确定的客观数值,还是一个基于可测量和不可测量因素的合理的,专业的意见/判断,这两个概念事实上并非互不相容,而是一个矛盾的统一体。因此,即便统一NOAEL的各种定义的困难不小,作为抛砖引玉之举,小编仍然综合考虑上述定义,归纳一个尽可能完整的NOAEL定义及其内涵如下。在以下的讨论中,似乎有必要区别真实(理论值或定义值)值(True NOAEL/LOAEL,等)和实测值(MeasuredNOAEL/LOAEL,等)。
(真实)未观察到不良效应水平(True NOAEL)是:
A. (真实)未观察到不良效应水平(True NOAEL):与对照组相比较,且在特定时期 (即暴露期加恢复期)内,在统计学或生物学意义上没有显著增加受试人群中"不良效应"的频率或严重程度的剂量或暴露水平。在此以上的剂量/暴露水平,不良效应就会表现出来。
B.(实测)未观察到不良效应水平(Measured NOAEL):满足(真实)未观察到不良效应水平(True NOAEL)的定义并且与毒理学研究中选定的某个剂量相吻合的剂量/暴露水平。
C. Trueor measured NOAEL会引起一些具有生物学意义的效应(受制于分析技术灵敏感度),但它们不被视为不良,也不被视为不良效应的前兆。即使在统计上与对照组有显著差别,也不会自动构成毒理义上的 "不良效应" 或显著的毒性,因为: 一方面,多终点的毒理研究在统计上显著的差异可能偶然发生;另一方面,随剂量变化的趋势可能具有生物学和毒理学意义,尽管并不具有显著统计学意义。
对于上述归纳需要注意:
1. 对于不同的动物种属,不同类型的毒理学研究 (如单剂量、多剂量等),NOAEL(True或Measured NOAEL)有着不同的数值。
2. True和Measured NOAEL剂量产生的效应在统计学或生物学意义上分别不同于在True和Measured LOAEL (最低可观察到不良反应水平)上观察到的 "不良" 效应。
3. MeasuredNOAEL永远低于True NOAEL并且是其下限;而Measured LOAEL永远高于True LOAEL并且是其上限(如图1所示)。
4. 我们通常使用的NOAEL是Measured NAOEL,它满足True NOAEL的定义并与毒理学研究中选定剂量相吻合。因此,Measured NOAEL数值,除开对不良效应的定义之外,在相当的程度上取决于毒理研究中剂量的选择。
5. 具有统计意义的发现不会自动构成对生物体的不良效应或毒理学显著的影响。偏离正常范围的幅度、超出正常范围的一致性以及异常反应与正常的动物生理、物理、生化和代谢的关系都必须加以考虑。普遍经验表明,一些有害的效应可能在统计上并不显著, 而一些统计上显著的变化可能不会造成伤害。因此, 研究组与对照组之间的毒理学终点在统计意义上的显著差异既不必要, 也不足以界定 "不良效应"。
6. 由于毒理研究中剂量选择的离散性质,生物效应的连续性以及测量中的误差,True NOAEL和True LOAEL可能无法直接测定,但有可能用数学的方法推定。应当认识到, 毒性研究必须限于少数的定量观察点(剂量或浓度水平),尽管生物响应可能随着剂量变化而发生连续变化。因此,不良效应和无不良效应水平的数值指标(quantitative indices),LOAEL和NOAEL,以及剂量-响应曲线,仅代表示对所研究的生物效应的近似真实的描述。
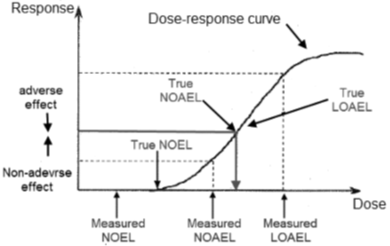
图1. 毒理学研究的定量结果取决于观察节点(即剂量/暴露量水平的选择)
上述定义和考量在很大程度上导致NOAEL的模糊性。这也是为什么上文中NAOEL可以被定义为一个“专业意见/判断”。这样的解释也显然有其合理性,但也造成了有关NOAEL是一个通过严格的实验而确定的客观数值,还是基于可测量和不可测量因素的一个合理判断的争论和疑惑。最终,真实的NOAEL(True NOAEL)很可能无法直接测定。实测NOAEL(Measured NAOEL)本身是一个是通过严格的实验建立起来的客观数值, 虽然具有内在的变异或不确定性。除开对不良效应的定义外,该数值还取决于毒理实验设计,即受试药物剂量的选择,也受制于一些生物学,病理学和统计学的相关因素。因此,可以说,true 或measured NOAEL是一个基于数值的专家意见(Professional judgement/opinion based onexperimental data),即:它既是客观实验数据,也是专家意见,二者不可分割。这一初始数值也可能随后以迭代的方式,通过实验的或其它手段,得到调整,并形成对被测试物毒理学概况的描述,以全面反映预期的药理学效应和意外的毒理学效应。
全文总结和前瞻
美国的毒理病理学学会 (Society of Toxicological Pathology, STP) 提出了一个相关指南或"最佳做法"(Kerlin et al 2016), 用于确定、交流、并使用非临床研究中获取的某个医药产品的不良效应数据。这些数据可以使医生和监管机构更好地认识该产品对人类构成的潜在风险。虽然该指南主要考虑了生物药/化学药的安全性问题,但其中涉及许多毒理学的基本原理和逻辑,也同样适用于评估医疗器械,食品和用于环境的化学品的安全性。
每个医药产品厂商的最终责任是:确保在特定产品的毒理学研究文档,非临床研究概述性文档以及用于临床申报的文件中对毒理学研究结果给出清晰和一致的解释以及对是否与对人体的潜在危害的相关作出判断。虽然可以使用各种方法达到这一目标,毒理病理学学会提出的指南代表着首选的方法,以促进在毒理学研究和摘要文件中澄清不良效应和及其与人体风险的相关性。
如果能在非临床报告中更一致、更透明地应用不良效应的概念来提高对毒理数据的清晰解读, 将改善临床/上市申请时与监管机构的沟通,这会使临床医生和负责保护人类健康的监管机构都同样受益。如果厂商不能明确地证明其能合理地判定被测试药物的不良效应,监管机构在厂商提交产品上市申请时就可能质疑其对非临床数据的整体解释,并采用更保守的不良效应标准以提高安全性。
对"不良效应性"的评估是将经验性的测量(即客观数据)与基于已建立知识体系的主观判断结合起来,以确定某个效应是否对生物体的健康有害。同时,业界已在尝试使用定量方法达到此目的,例如使用 "临界效应点",它定义了对单个生物体而言的毒理学效应(用于连续数据,例如,与对照组的平均值相比,红细胞计数减少10%;Dekkers et al, 2006)的不良和非不良变化之间的临界点或断裂点。然而,这些定量方法在不同物种、性别和年龄的动物上的适宜性尚未得到充分评估。因此,在制定非临床研究中对不良效应的解释和数据报告的规范/准则时,应保持灵活性,以确定那些发现是不良或非不良,同时努力增加对不良效应解释的一致性和透明度。
现有的毒理学试验设计是基于识别受试动物对药物在某一剂量下所造成的不良效应,并将其作为随后的风险评估和监管机构做决定的出发点。当前,体外预测工具和技术的迅速扩展将产生越来越多的毒理学终点(Endpoints)和描述潜在影响的marker,以及对复杂的毒理信号传输网络,通路的描述, 这些都可能是可用的安全和风险指标。综合分析这些数据之后有可能引入新的毒性marker,这些marker需要在剂量-响应关系、它们与体内生理系统的响应以及与人类风险的相关性方面得到充分的表征,然后才能适当的运用到临床前安全评估之中。小编认为这也会给“不良效应”的定义和NOAEL的确立带来新的挑战,探索和进步。
特别声明
本文如有疏漏和误读相关指南和数据的地方,请读者评论和指正。所有引用的原始信息和资料均来自已经发表学术期刊,官方网络报道等公开渠道,不涉及任何保密信息。参考文献的选择考虑到多样化但也不可能完备。欢迎读者提供有价值的文献及其评估。
扩展阅读
1.
如何判定药物毒理研究中的不良和非不良效应(二)
: 2019-02-20. 游方和尚, 生物制药小编
2.
如何判定药物毒理研究中的不良和非不良效应(一)
: 2019-01-18. 游方和尚, 生物制药小编
3.
如何决定单克隆抗体药物在首次人体临床研究时的起始剂量(一)
: NOAEL方法 2018-04-13. 游方和尚, 生物制药小编
参考文献
1. U.S.FDA-CDER (U.S. Food and Drug Administration, Center for Drug Evaluation andResearch). (2005). Guidance for industry: Estimating the maximum safe startingdose in initial clinical trials for therapeutics in adult healthy volunteers. http://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/ucm078932.pdf.
2.
Suh H Y, Peck C C, Yu K S, et al. Determination of the starting dose in the first-in-human clinical trials with monoclonal antibodies: a systematic review of papers published between 1990 and 2013[J]. Drug design, development and therapy, 2016, 10: 4005.
3.
Lewis R W, Billington R, Debryune E, et al. Recognition of adverse and nonadverse effects in toxicity studies[J]. Toxicologic Pathology, 2002, 30(1): 66-74.
4.
Greaves P, Williams A, Eve M. First dose of potential new medicines to humans: how animals help[J]. Nature Reviews Drug Discovery, 2004, 3(3): 226.
5.
Olson H, Betton G, Robinson D, et al. Concordance of the toxicity of pharmaceuticals in humans and in animals[J]. Regulatory Toxicology and Pharmacology, 2000, 32(1): 56-67.
6. IRIS (Integrated RiskInformation System). (2007). U.S. Environmental Protection Agency. IntegratedRisk Information System (IRIS): Glossary of IRIS terms. www.epa.gov/iris.
7.
Renwick A G, Barlow S M, Hertz-Picciotto I, et al. Risk characterisation of chemicals in food and diet[J]. Food and Chemical Toxicology, 2003, 41(9): 1211-1271.
8. Sergeant A. Ecological risk assessment: History and fundamentals. In Human and Ecological Risk Assessement: Theory and Practice (D. Paustenbach, ed.), 2002, pp.369-442. John Wiley and Sons, New York.













