2017年4月10-11日 北京友谊宾馆
主办单位:北京大学药物信息与工程研究中心
协办单位:上海东富龙科技股份有限公司
支持单位:中国药促会、亦弘商学院、识林知识平台
媒体支持:Insight数据库、同写意、蒲公英
承办单位:艾美达(北京)医药信息咨询有限公司
中美药监部门生物等效标准(BE)制定和审评的主要专家、《FDA生物等效性标准》专著主编和作者、及业界专家同堂探讨BE的技术要求和监管考量。BCS分类理论创建者、Gordon Amidon教授介绍体内外相关性及有体内预测力的溶出方法的最新进展。
会议注重BE的科学性和案例讨论,例如: 高变异、窄治疗窗、特殊制剂的试验方案设计,预BE试验设计与实施,试验常见缺陷,偏离试验方案的考量,如何不增加受试者例数而得到可靠结果,仿制药和新药BE审评关的注点等。
会议主要面向药企及研发机构、CRO及临床基地的管理与实施者。
日程
第一天 4月10日
第二天 4月11日
报告专家简介
余煊强 博士
美国密歇根大学教授,美国药学会(AAPS)杰出会员、美国药学会杂志副主编,现在美国FDA负责仿制药和新药质量审评和管理工作,《FDA生物等效性标准》专著主编。曾在美国辉瑞-普强公司及葛兰素威康公司工作,并创建了分室吸收和转运模型。曾获美国密歇根大学博士学位。
GORDON AMIDON 博士
美国密歇根大学Charles R. Walgreen Jr.讲席教授。其与美国FDA合作创建的BCS分类系统为全球药监机构、企业和学术界广泛接受,影响了生物等效标准的建立。曾任美国药学会主席、美国缓控释制剂协会主席。曾获美国密歇根大学博士学位。
杨进波 博士
食药总局CDE统计与临床药理学部负责人,主要承担药品注册申请的生物统计学、临床药理学和生物等效性审评等工作。主任药师,先后在CDE进口药部、审评三部、化药临床二部从事药品技术审评工作。曾获华中科技大学同济医学院博士学位。
杨永胜 博士
美洲华人药学会会长,在美国FDA仿制药办公室长期从事BE研究和审评工作,《FDA生物等效性标准》专著作者。曾任美国密歇根大学药学院研究人员。曾获我国华南农业大学博士学位。
孙笃新 博士
美国密歇根大学William I. Higuchi特聘讲席教授,药代动力学技术平台中心主任,负责美国密歇根大学综合癌症中心化学生物项目、跨学科药物化学项目,任美国FDA制药科学和临床药理学咨询委员,《FDA生物等效性标准》专著作者。曾获美国密歇根大学博士学位。
魏春敏 博士
食药总局CDE新药审评专家,曾主持或参与完成新药I期人体耐受性、人体药代动力学或人体生物等效性试验研究30余项,主持国家自然科学基金等课题四项。曾获山东大学医学院博士学位。
方忻平 博士
上海药明康德新药开发有限公司,生物分析服务部全球负责人,曾任美国FMC公司研发中心的药物代谢动力学研究员,Purdue Pharma.L.P. 生物分析部助理总监,美国诺华公司DMPK生物分析部副总监。曾获美国普渡大学博士学位。
研讨专家简介
李冰 博士
美洲华人药学会副会长,现在美国FDA从事BE及仿制药审评管理工作,《FDA生物等效性标准》专著主编。曾在美国百时美施贵宝公司从事药物研发工作。曾获美国威斯康星大学麦迪逊分校博士学位。
张玉琥 先生
中国药学会药剂专业委员会委员,中国生物分析协会专家委员会委员。曾在食药总局CDE长期从事药学和BE审评工作,曾长期从事缓控释制剂等新药研发工作。
注册参会
收费标准
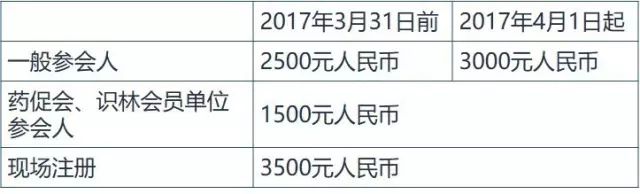
注册报名注册费含会议资料、茶歇和午餐
即日起登录网站( http://www.cpier.pku.edu.cn)、点击文末阅读原文或长按识别下方二维码,在线报名。

联系方式
电话:010-62755647 / 62758023
邮箱:[email protected]














