
科研经验 | 文献 | 实验 | 工具 | SCI写作 | 国自然

作者:亢小玉
转载请注明:解螺旋·临床医生科研成长平台
初次接触流式细胞术检测细胞凋亡实验还是在研一的时候,那时候不由分说按照说明书的实验步骤,第一步,第二步....结果一年过去了,应该着色的不着色,应该凋亡的不凋亡,终于经过一年的不断思考和实验操作的改进,研二有了果断的进步。现在终于有机会和大家一起分享,为什么研一的流式研二才出结果?
为了方便大家理解我先呈现了一个结果图如下,就是因为这个结果图困惑了一年,因为我的实验结果,总是会出现这样那样的非正常的现象:
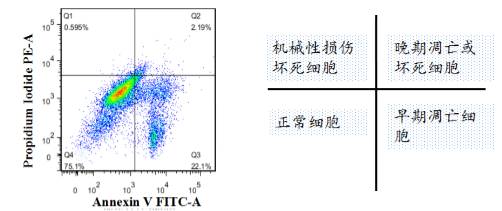
现象(一)当做单阳管Annexinv-FITC时,第四象限总是为空,没有早期凋亡的细胞,98%都是正常细胞;
现象(二)当做单阳管PI时,第二,三象限也总是为空,98%都是正常细胞;
现象(三)好不容易单染实验可以着色,但是在加药观察细胞凋亡的情况时,总是不尽人意,第三象限总是比第四象限细胞百分比多;
现象(四)在实际操作实验中,第二象限代表机械性损伤的细胞总比第四现象早期凋亡的百分比多;
现象(五)细胞染色不分团,做不到理想的流式结果图。
这四个象限做了一年都没有理想的结果,但是也经过这一年的时间潜心的总结和弄透了原理及方法,终于做出了客观的结果。下面我就给大家总结一下我的学习经验。希望对正在做流式细胞术检测凋亡实验的你能够答疑解惑。
从细胞结构开始说起
真核细胞的三大重要结构为细胞膜,细胞核和细胞质。细胞的周围有一层由脂分子双层和蛋白质构成的单位膜,称之为细胞膜或质膜。质膜具有通透性,脂溶性的物质很容易通过质膜,水溶性物质包括小分子,是很难透过质膜,如果想要穿过质膜,需通过通道实现。
细胞膜上的膜脂约占膜的50%,主要分为3类,磷脂,鞘脂,和固醇类。而磷脂约占膜脂的50%,磷脂的分子结构特点。其头部基团由带负电的磷酸基团结合氮碱基构成,例如胆碱,乙醇胺,丝氨酸和肌醇等。尾部由两条长短不一的烃链构成,为非极性的输水区如下图(1)。膜脂的分布具有不对称性如下图(2)。

图(1)
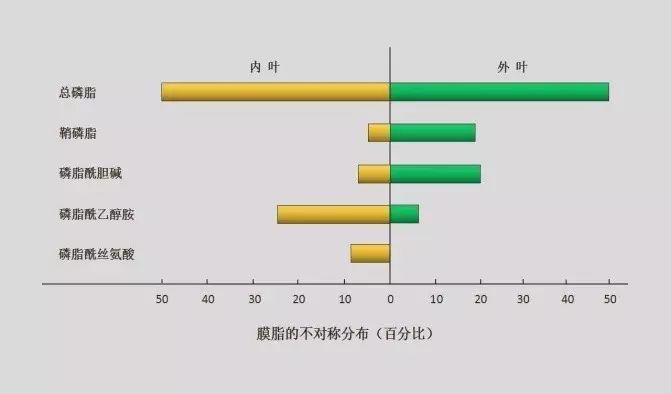
图(2)
细胞凋亡的概念
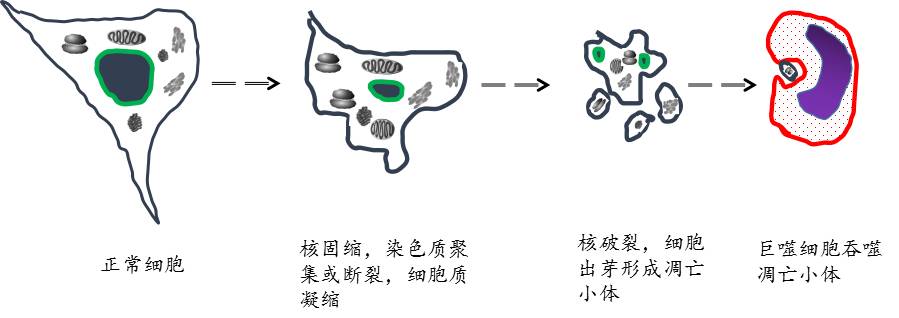
是细胞的一种程序性死亡,首先细胞会轻微的蜷缩,染色质会聚集和断裂,并且细胞质也凝缩;继而细胞核破裂,细胞通过出芽的形式形成一个个凋亡小体,凋亡小体有细胞膜封闭,而且会被吞噬细胞吞噬,所以不会有内容物释放,故不会发生炎症如下图。
分析流氏试剂的原理
Annexin V 是一种分子量为35~36kD 的Ca2+依赖性磷脂结合蛋白,能与磷脂酰丝氨酸(PS)高亲和力特异性结合。将Annexin V 进行荧光素(常用FITC、PE或Biotin 标记),以标记了的Annexin V 作为荧光探针,利用流式细胞仪或荧光显微镜可检测细胞凋亡的发生。
碘化丙啶(propidine iodide,PI)是一种核酸染料,特异性质是不能透过完整的细胞膜,但在凋亡中晚期的细胞和死细胞,PI 能够透过细胞膜而使细胞核染色,发红光。因此将Annexin V 与PI 匹配使用,就可以将凋亡早晚期的细胞以及坏死细胞区分开来。
磷脂酰丝氨酸(Phosphatidylserine,PS)活细胞中,PS主要存在于细胞膜的内测小叶如图(2),当细胞接受凋亡刺激后,PS通过依赖ATP主动运输机制以及在ATP依赖的磷脂转位酶的作用下从细胞膜的内叶翻转到细胞表面,从而暴露在细胞外环境中,因其带有磷酸基团的负电,从而被高亲和力的Annexin V识别并结合。
最后分析实验步骤
1.收样。将细胞浓度控制为每管为106 个/ml,取200 ul, 1000 rpm×3 min。贴壁的细胞需用胰酶消化注意不含EDTA。
2.PBS清洗2-3次,1000 rpm×3 min离心。
3.将细胞重悬于100 ul binding buffer,分别加入2 ul Annexin-V-FITC和PI,轻轻混匀,避光37孵育箱上放置10分钟。
4.转至流式检测管,每个样品临上机前加入400 ul左右PBS稀释和过滤,30分钟内迅速检测。
经过反反复复对这四个方面进行分析研究,最后才总结出我的实验问题,如下:
第一,根据细胞膜结构和细胞凋亡的概念分析,细胞凋亡是程序性的过程,我在加药损伤等待细胞早期凋亡的时间上正好去捕捉到它的合理的百分比,是非常困难的。因此在得到合理的百分比的时间我必须要做的实验是利用最简单的DAPI染色或者Hochest染色,观察加药时间的时间点上细胞核的状态变化,准确判断细胞早期凋亡发生的时间点;
第二,根据细胞膜结构和流式试剂的原理分析,保证细胞膜的完整性,Annexin V在早期凋亡才能染上,因为早期凋亡是染色在细胞膜上,因此可想而知,如果细胞在收样处理的时候,细胞膜破损,那是一定染色不上去的,所以尽可能的减少细胞膜的破损,不用EDTA的胰酶消化和尽可能的等细胞边缘变圆有脱落的时候再用枪头吹打;
第三,根据流式试剂和流式仪器分析,细胞取样时为了避免染色不上和堵塞流式进样管,必须将细胞消化清晰不可有粘附或者成团抱在一起,可在消化以后镜下观察(必须得进行的操作);
第四,根据流式试剂的原理分析,染色要避光,Annexin V一般是标记上的荧光,如FITC携带绿光。而且染色的时候细胞内buffer需要充分混匀;
第五,根据流式仪器分析,上机检测之前,尽可能在显微镜下观测,细胞膜有没有着绿色,细胞核有没有着红色,直接可以观察到早期凋亡和坏死细胞,并且在有根据的情况下去上机检测;
第六,根据流式仪器分析,一般情况下需要设置组别如下表,当单阳管染色不上,补偿调剂不好的时候需要与操作流式染色的工作人员沟通,是用活细胞做单阳管染色,还是处理过的细胞做单阳管染色,并调节补偿,达到最理想的实验效果。
名称(管数) | Annexin V-FITC | PI |
阴性对照(1) | - | - |
单阳1管(1) | + | - |
单阳2管(1) | - | + |
样本管(n) | + | + |
















