
▎药明康德/报道
昨日,专注于四环素衍生物开发及市场化的创新生物技术公司Paratek Pharmaceuticals宣布了一项关键性3期阶段临床研究结果:与每日两次口服型利奈唑胺(linezolid)治疗方案相比较,评估了每日一次口服omadacycline治疗急性细菌性皮肤和皮肤结构感染(ABSSSI)的功效。该研究达到了美国FDA和欧盟药物管理局(EMA)支持该适应症获批所需的所有主要和次要终点。这也代表着omadacycline获得了第三个3期注册临床研究成功。
Omadacycline是一种新型口服施用或静脉注射的一天一次抗生素,对Gram阳性、Gram阴性和非典型细菌具有广谱活性。它正在被开发作为社区获得性细菌感染的经验性治疗,包括急性细菌性皮肤及皮肤结构感染、社区获得性肺炎(CABP)、尿路感染及其他社区获得性感染。Omadacycline在美国已经获得合格传染病产品(QIDP)认证和快速通道资格。
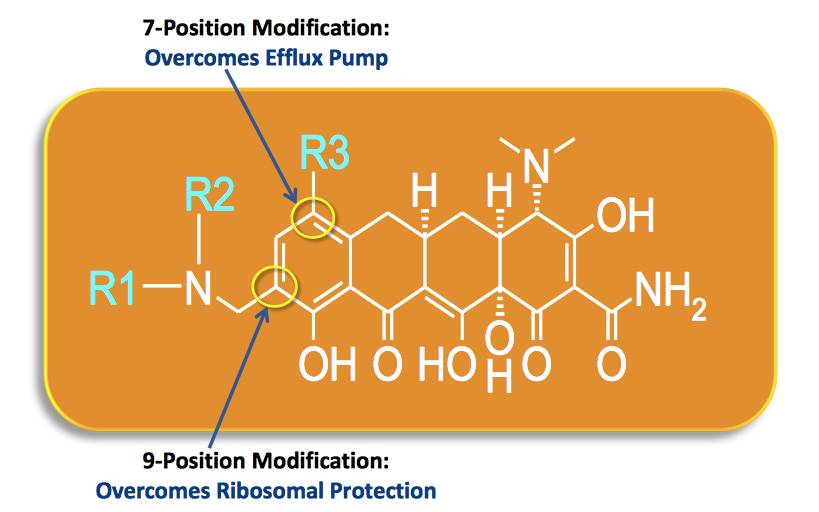
▲Omadacycline是一种改良的新型四环素(图片来源:Paratek官网)
与每日两次只口服(twice-daily, oral-only)利奈唑胺相比较,研究人员在名为OASIS-2、涉及735例ABSSSI成人患者的关键性3期临床研究评估了每日一次只口服(once-daily, oral-only)omadacycline方案的疗效和安全性。接受第一剂药物48〜72小时后,在早期临床反应(ECR)指标中,与利奈唑胺相比,omadacycline达到了FDA在修订意向治疗(mITT)人群(10%NI保守度,95%置信区间)中指定的统计学非劣性(NI)主要终点。Omadacycline 的ECR率为87.5%,而利奈唑胺为82.5%。针对最常见的ABSSSI病原体(包括耐甲氧西林金黄色葡萄球菌,MRSA)引起的感染,omadacycline具有高的临床成功率。Paratek将在2018年第一季度向美国FDA提交该药物的NDA。
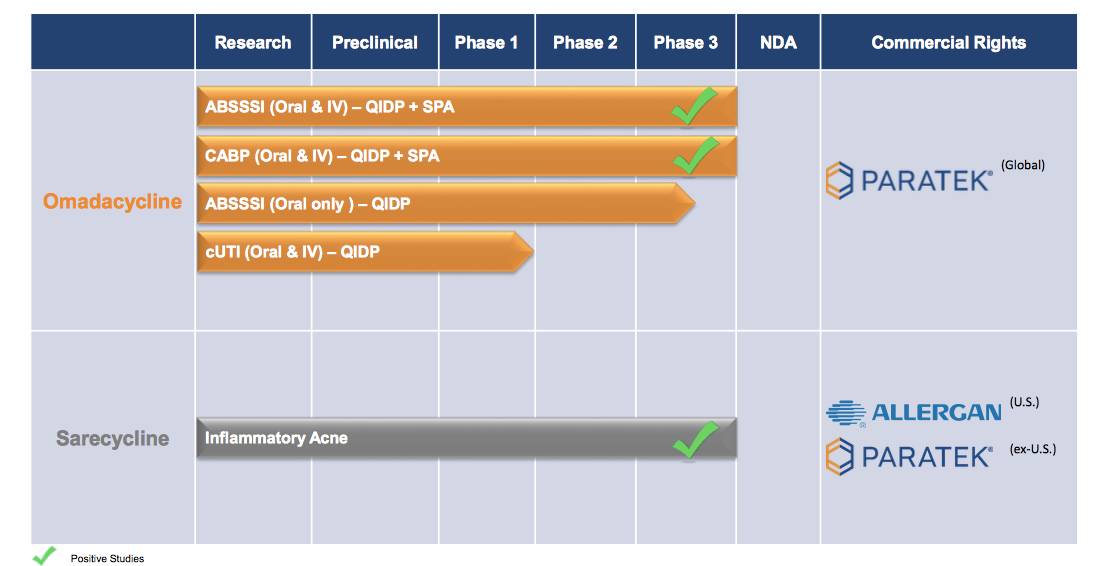
▲Paratek的在研产品线(图片来源:Paratek官网)
Paratek公司首席运营官兼首席医疗总裁Evan Loh博士说道:“我们对只口服给药皮肤感染适应症研究中观察到的卓越疗效感到兴奋,这与OASIS-1和OPTIC研究中观察到的疗效一致。本研究的完成率和有效率非常高,证实了omadacycline只需口服方案的效益,以及我们对omadacycline获得ABSSSI和CABP批准的信心。”

▲Paratek公司董事长兼首席执行官Michael Bigham先生(图片来源:Paratek官网)
Paratek公司董事长兼首席执行官Michael Bigham先生说道:“这项成功的研究表明了omadacycline的只口服给药方案具有治疗潜力,这将有助于门诊治疗,并可能减少病人住院的需求。只需口服给药方案的效用对于那些需要新型有效药物来对付严重社区获得性感染的患者益处很大。”
参考资料:
[1] Paratek Pharma (PRTK)'s Antibiotic Meets All Endpoints in Late-Stage Study
[2] Paratek Pharmaceuticals官方网站

















