
染色质的3D组织可调节许多基因组功能。但是,由于可以在单个细胞中成像的基因组位点数量仍然有限,因此仍然缺少单个细胞中整个染色体的高分辨率视图,更不用说单个细胞中染色质组织的基因组规模视图了。2020年8月20日,哈佛大学庄小威及Bogdan Bintu共同通讯在Cell 在线发表题为“Genome-Scale Imaging of the 3D Organization and Transcriptional Activity of Chromatin”的研究论文,该研究报告了一种成像技术,用于以高通量基因组可视化单个细胞中多个尺度的染色质组织。首先,该研究证明了通过有序的杂交对数百个基因组位点进行的多重成像,可以对整个染色体进行高分辨率构象追踪。接下来,该研究报告基于多重荧光原位杂交(MERFISH)的基因组规模染色质跟踪方法,并演示了同时成像的1000多个基因组位点和1000多个基因的转录本以及具有标志性的核结构。使用这项技术,该研究可以表征染色质结构域,区室和跨染色体相互作用以及它们与单细胞转录的关系。该研究预想了这种高通量,多尺度和多模式成像技术的广泛应用,该技术在其天然结构和功能背景下提供了染色质组织的完整视图。

基因组的3D组织调节从基因表达到DNA复制的许多基本细胞功能。生化和影像学测量揭示了各种规模的复杂染色质结构。特别是高通量染色体构象捕获方法,例如Hi-C,基因组结构图谱(GAM)和其他基于测序的方法,已经揭示了染色质结构,例如结构域和区室,并具有全基因组视野。值得注意的是,染色质被划分为具有增强的自我相互作用的基因组区域,称为拓扑相关域(TADs),这些区域经常受到共同调控基因和边界与调控表观遗传元素相吻合。在更大的规模上,染色质被分为A和B隔室,分别对活性和非活性染色质进行富集。A / B区划分的生理学意义与其在发育过程中以及细胞类型之间的变化有关。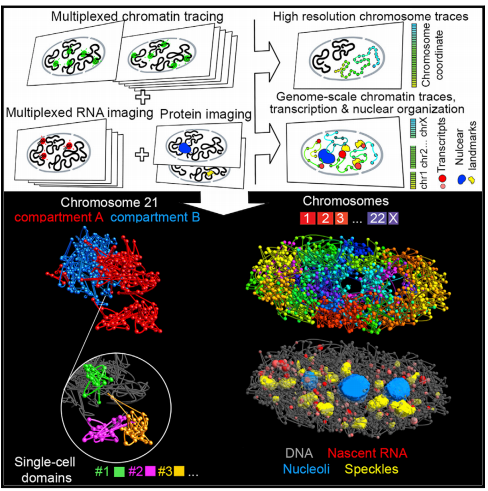
尽管这些基于高通量测序的方法功能强大且极大地丰富了我们对3D基因组组织的了解,但它们提供了成对染色质基因座的联系信息,但不能提供单个基因座的直接空间位置信息。此外,大多数关于染色质组织的全基因组洞察都建立在数百万个细胞的种群平均接触图上。尽管单细胞Hi-C方法最近有所改进,但对单细胞中3D基因组组织的研究仍然是一项艰巨的任务。此外,尽管出现了将Hi-C与其他测量模式结合的方法,例如,在相互作用蛋白的背景下提供染色质接触的表征,核结构或DNA修饰。通过测序进行多峰测量仍然具有挑战性。值得注意的是,尽管需要这样一种方法来进一步了解染色质组织如何调节转录,但尚未出现允许在同一细胞中进行染色质组织和转录活性的基因组规模测量的方法。另一方面,基于成像的方法可以直接检测单个细胞中染色质基因座的空间位置,检测效率很高。特别是,荧光原位杂交(FISH)可对固定细胞中的染色质基因座进行高特异性检测,而CRISPR系统大大增强了我们对特定染色质基因座成像的能力。但是,当前的成像方法在序列空间中的通量有限,传统上一次只能研究几个基因组位点。研究人员最近通过连续几轮FISH成像开发了一种染色质示踪方法,可以在单个细胞中成像数十个不同的染色质基因座。这种方法提供了对染色质结构及其与转录关系的见解。但是,由于可以在单个细胞中成像的基因组位点数量仍然有限,因此仍然缺少单个细胞中整个染色体的高分辨率视图,更不用说单个细胞中染色质组织的基因组规模视图了。在这里,该研究报告了一种多尺度的多重FISH成像技术,该技术可以在单个细胞中以各种分辨率和基因组覆盖率同时成像数百个到1000多个不同的基因组位点。使用这种方法,该研究进一步证明了同时存在超过1000个基因组位点的成像,以及这些基因座和标志性核结构(包括核斑点和核仁)中驻留的1000多个基因的新生RNA转录物。这种方法使研究人员能够将染色质组织置于其天然的结构和功能环境中,从而探索单个细胞中染色质组织,转录活性和核结构之间的关系。https://doi.org/10.1016/j.cell.2020.07.032

—END—
内容为【iNature】公众号原创,欢迎转载
白名单回复后台「转载」
觉得本文好看,请点这里↓













