

肺癌是当今世界上发生率和死亡率最高的恶性肿瘤之一,且呈上升趋势,目前全球范围内新发肺癌患者每年已经超过100万例,其死亡率在男性和女性患者中均占恶性肿瘤死亡率的第1位。另有国外资料显示肺癌的病理学类型发生了明显变化:肺腺癌发病率迅速增加,目前已取代肺鳞癌的发生率,成为最常见的肺癌病理类型。尽管采用了手术、放疗和化疗等综合治疗措施,由于转移和多药耐药等原因,非小细胞肺癌5年生存率仍低于10%。近年来,新兴的肿瘤分子靶向治疗意在针对肿瘤内特异的分子治疗靶点,利用一定的分子技术阻断分子的生物学功能,进而从分子水平逆转肿瘤细胞的恶性生物学行为,达到抑制肿瘤生长的目的[1]。Survivin是新近发现的凋亡抑制蛋白,它选择性地表达于恶性肿瘤组织中。RNA干扰(siRNA)是一种新的基因阻断技术,有类似于基因敲除的效果。靶向Survivin的RNA干扰可以阻断Survivin基因表达,显著抑制肿瘤细胞的生长。目前普遍认为中医药在预防肿瘤、增强患者的免疫功能、对放化疗的解毒增效、抗复发转移及延长患者的生存期、改善生活质量等方面均有其独特优势。多年来,大量临床研究结果表明[2-4],以消岩汤为基础的中医药对非小细胞肺癌具有明显的抑瘤及减毒增效作用。本实验以人肺腺癌A549实体移植瘤裸鼠模型为研究对象,将消岩汤含药血清及siRNA(smallinterfering RNA)转染后的A549细胞分别进行瘤内注射,通过流式细胞术观察小鼠体内肿瘤细胞凋亡情况;免疫细胞化学法检测肿瘤组织中Survivin蛋白表达量,明确消岩汤抗肿瘤作用靶点及作用机制,为消岩汤在临床抗肿瘤治疗中提供有力的理论依据。
1 材料
1.1 实验动物
BalB/C裸鼠40只,SPF级,雄性,体质量(19.6±2.3)g,购自北京维通利华实验动物技术有限公司,生产许可证SCXK(京)2012-0001,经中国医学科学院放射医学研究配制的动物标准颗粒饲料适应性饲养1周后进行实验。
1.2 瘤株
天津医科大学附属肿瘤医院中心实验室提供人肺癌A549细胞系,传代培养于Hyclone公司的RPMI 1640培养液中,37 ℃、5% CO2条件下,饱和湿度,贴壁生长。
1.3 药物与试剂
消岩汤组方药材为黄芪30 g、太子参15g、郁金10 g、姜黄10 g、夏枯草15g、白花蛇舌草15 g、生牡蛎30 g、蜂房15g,消岩汤各组方药材均由天津中医药大学第一附属医院药房提供。消岩汤水煎液自制,生药共计140 g先用凉水浸泡30 min,用水量为生药量的8倍,武火煎沸后,文火煎30 min,滤出药液;再加6倍量水煎沸后文火煎20 min,滤出药液,合并2次煎液,浓缩至300 mL,生药量为0.42 g/mL。氯化钠注射液(生理盐水),250 mL,中国大冢制药有限公司;二甲基亚砜(DMSO,分析纯)、RPMI 1640培养基(批号1285082)、免疫组化试剂盒、Survivin抗体,均由天津科瑞杰生物技术开发有限公司提供。Lipofectamine 2000转染试剂购自Promega公司,siRNA片段由上海生工生物工程股份有限公司合成提供。
1.4 仪器
LD4-2台式离心机,北京医用离心机厂;EA2004电子天平,上海天平仪器厂;超净工作台,苏州净化设备公司;倒置显微镜,日本Nikon;恒温水浴箱,北京医疗设备厂;722紫外可见分光光度计,上海分析仪器厂;C-2021CO2孵育箱,TyTe公司;yxQG02内热蒸汽消毒器,山东新华医疗器械厂;M200酶标仪,TECAN公司(芬兰);96孔板,Greinerbio-one公司;流式细胞仪,美国BECKMAN-COULTER(贝克曼-库尔特)公司。
2 方法
2.1 消岩汤含药血清的制备
健康BalB/C小鼠,分为2组,每组20只,分为对照组和消岩汤组,消岩汤的剂量均以生药量计,根据前期进行的急性毒性实验结果,消岩汤的最大给药剂量为304 g/kg,相当于成人临床推荐日用量的130倍,未出现明显毒副作用。前期研究表明,消岩汤按40 g/kg(为临床成人日用量的20倍)ig给药对顺铂诱导的A549/DDP耐药细胞的凋亡具有显著的增强作用[2]。故本研究以消岩汤按40 g/kg(为临床成人日用量的20倍)ig给药;对照组ig 0.4 mL生理盐水。每次给药间隔24 h,连续14 d。末次给药后禁食、禁水12 h,眼眶取血法采血,无菌分离血清,经56 ℃,30 min灭活处理后,用0.22 μm微孔滤膜滤过除菌,置−20 ℃保存空白血清和消岩汤含药血清。
2.2 siRNA转染A549细胞的制备
在Invitrogen公司的网上设计系统(http://www. invitrogen.com)中设计的靶向Survivin基因的siRNA序列:正向引物CTGAGAACGAGCCAG-ACTT,反向引物AAGTCTGGCTCGTTCTCAG。按照说明书稀释退火形成双链dsRNA,所涉及序列经BLAST查询,排除其他基因同源性。将对数生长期的A549细胞接种于6孔板中,待细胞贴壁生长至80%融合时,磷酸盐缓冲溶液清洗1次,更换无血清培养基,按照Lipofectamine 2000转染试剂说明书进行转染48 h[5]。
2.3 实验动物分组
通过SAS软件得出随机数字,按1∶1∶1∶1,将小鼠分为模型组、消岩汤组、siRNA转染组、消岩汤+siRNA转染组,共4组,每组10只裸鼠,饲养在SPF级屏障系统内设IVC环境内,5只动物同一塑料盒中,给予SPF级动物专用料块,自由饮用蒸馏水。饲养室温度(20±5)℃、日温差≤3 ℃,相对湿度40%~60%、光照12 h明暗交替,空气洁净度为100级,氨质量浓度≤14 mg/m3,噪声≤60分贝,工作照度为150~300 lx,动物照度为100~200 lx。
2.4 A549荷瘤小鼠模型的制备
取接种肿瘤7~10 d状态良好的荷瘤(腹水型)动物,常规消毒后抽取少量腹水,推片瑞氏染色细胞分类证实肿瘤细胞数不少于75%后将腹水抽出,以腹水与生理盐水按1∶4比例稀释,制备成接种用的肿瘤细胞混悬液。肿瘤细胞混悬液的制备均在无菌条件下(超净工作台中)完成。吸取上述制备的肿瘤细胞混悬液0.2 mL接种于小鼠右侧腋窝皮下,从取出肿瘤腹水至肿瘤接种完毕在60 min内完成。观察7d,肿瘤直径约1 cm,造模成功率为100%[6]。
2.5 给药方案
模型组、消岩汤组、siRNA转染组、消岩汤+siRNA转染组造模成功的小鼠分别瘤内注射生理盐水、消岩汤含药血清、Survivin siRNA转染的A549细胞,注射体积50 μL,隔天注射1次。连续给药2周[7]。
2.6 观察指标
2.6.1 一般状态 每天观察并记录各组小鼠的体质量、精神状态、进食及活动情况。
2.6.2 肿瘤生长情况 于末次注射给药后24 h,处死动物,剥取肿瘤组织,称瘤质量,计算抑瘤率。
抑瘤率=1-给药组瘤质量/模型组瘤质量
2.6.3 肿瘤组织学检查 取出各组裸鼠的肿瘤组织,称质量,用刀片沿肿瘤组织正中间剖开,剥离坏死部分,制备肿瘤组织标本(约1 cm×1cm×1 cm)以4%多聚甲醛固定,置于4 ℃冷藏备用,在60 ℃以下环境内经脱水、透明、浸蜡及包埋制成蜡块。
2.6.4 免疫组化法检测Survivin蛋白表达 免疫组化指标检测组织切片常规脱蜡、水化后,按相关试剂盒说明检测Survivin蛋白表达。其中,Survivin采用微波修复,抗体稀释度为1∶30。结果判断:Survivin蛋白阳性反应为棕黄色或棕褐色颗粒,Survivin主要定位于胞核或胞浆。采取染色强度和肿瘤细胞阳性率综合评价染色指数(IA),着色强度计分:无染色计0分,淡黄色染色为1分,黄色染色为2分,棕黄色染色为3分;阳性细胞率计分标准:0分为阳性细胞<5%,1分为阳性细胞比例5%~24%,2分阳性细胞比例为25%~49%,3分阳性细胞比例为50%~74%,4分阳性细胞比例为≥75%。IA为两项评分之和。
2.6.5 细胞凋亡情况 采用常规胰酶消化、收集肿瘤组织细胞1×106~5×106/mL,500~1 000 r/min离心5 min,弃去培养液,3 mL PBS洗涤1次;离心去PBS,加入冰预冷的70%乙醇固定,4 ℃,1~2 h。离心弃去固定液,3 mL PBS重悬5 min,400目的筛网滤过1次,500~1 000 r/min离心5 min,弃去PBS。用1 mL PI染液染色,4 ℃避光30 min。流式细胞仪检测:PI用氩离子激发荧光,激光光波波长为488 nm,发射光波波长大于630 nm,产生红色荧光分析PI荧光强度的直方图,也可分析前散射光对侧散射光的散点图。
2.7 统计学处理
数据为计量资料,以表示,在确定正态分布、方差齐的前提下组间比较采用t检验,如非正态分布,组间比较用非参数检验。使用SPSS 17.0统计软件包进行统计处理。
3 结果
3.1 A549荷瘤小鼠一般状况观察
接种A549瘤株后大约8 d,小鼠右前肢腋下长出肿瘤结节。自7 d后各组小鼠均逐渐出现行动迟缓、倦怠,喜群居,毛色晦暗,竖毛,进食减少情况,但各组小鼠一般状况并无明显差异。处死全部小鼠后,肉眼可观察肿瘤生长于小鼠右前肢腋下,呈灰白色结节,大部分包膜完整,少部分肿瘤结节包膜不完整,有浸润现象。
3.2 对A549荷瘤小鼠体质量及肿瘤生长的影响
与模型组比较,各给药组荷瘤小鼠体质量均有明显减轻(P<0.01)。各治疗组之间对比,小鼠体质量未见明显差异(P>0.05)。见表1。与模型组相比,各给药组瘤质量均显著降低(P<0.01),但各给药组间瘤质量差异不显著(P>0.05)。各给药组抑瘤率均在80%以上,见表1。
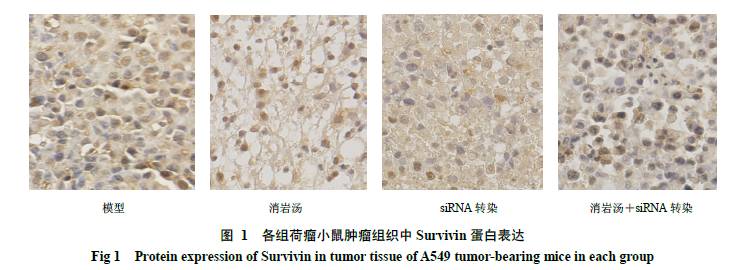
3.3 对A549荷瘤小鼠肿瘤组织中Survivin蛋白表达的影响
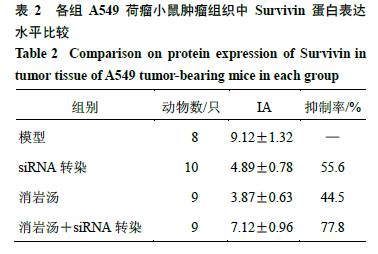
与模型组比较,各给药组荷瘤小鼠肿瘤组织中Survivin蛋白表达显著减少(P<0.01),siRNA转染组对Survivin蛋白表达的抑制率明显高于消岩汤组,但显著低于消岩汤+siRNA转染组。见图1和表2。
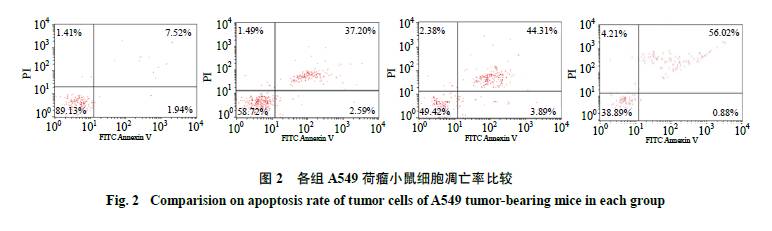
3.4 流式细胞仪检测细胞凋亡率
在流式细胞术双参数散点图上,左下象限显示活细胞,右下象限为早期凋亡细胞,右上象限为晚期凋亡细胞,左上象限是非活细胞,即坏死细胞。从图2中可看出,与模型组凋亡率9.46%相比较,siRNA转染组、消岩汤组、消岩汤+siRNA转染组细胞凋亡率分别为48.2%、39.79%、56.9%。与模型组相比,其余各组凋亡率从高至低依次为消岩汤+siRNA转染组、siRNA转染组、消岩汤组,且各组间差异均有统计学意义。提示siRNA转染组和消岩汤组均可诱导细胞凋亡,且siRNA转染组的诱导作用强于消岩汤组,消岩汤+siRNA转染组可协同诱导细胞凋亡作用。
4 讨论
像其他许多恶性肿瘤一样,肺癌的发生、发展以及侵袭、转移是多基因参与、多步骤发生的过程,与一系列的基因表达失衡有关,其中凋亡抑制基因的过度表达导致细胞凋亡不足和增生过度是肺癌发生的重要原因。
凋亡抑制蛋白(inhibitor of apoptosis protein,IAP)[8]是继Bcl-2家族后发现的又一类凋亡调控蛋白家族,是凋亡抑制蛋白基因表达的产物,因抑制细胞凋亡和参与肿瘤的发生成为近年来研究的热门靶点。Survivin是近年新发现的IAP家族成员,是该家族中迄今为止发现的相对分子质量最小、抗凋亡作用最强者,它选择性地表达于恶性肿瘤组织中,而在除胸腺和生殖腺外的正常成人组织中不表达,这种特点使其成为目前恶性肿瘤诊断和治疗的新靶点。在非小细胞肺癌中Survivin mRNA的阳性表达率越高,细胞分化程度越低,抑制细胞凋亡的作用越强,肿瘤细胞的浸润性越强,预后越差。提示在肺癌的发生、进展中起重要作用。RNA干扰技术是基因沉默的有力手段,宿主通过RNA干扰抑制病毒等外源核苷酸的表达,从而维护自身基因组的稳定性,通过人工导入一段与目的基因同源的双链RNA序列使其mRNA降解,表达缺失,实现基因敲除。以RNA干扰技术作用肺癌细胞,细胞的Survivin mRNA表达下降,凋亡率增高,且细胞的增殖和恶性侵袭能力被明显抑制[9]。
目前中医药作为肿瘤综合治疗的手段之一被临床广泛应用。目前普遍认为中医药在预防肿瘤,增强患者的免疫功能,对放化疗的解毒增效,抗复发转移及延长患者的生存期,改善生活质量等方面均有其独特优势。多年来,大量临床研究结果表明,以消岩汤为基础的中医药对非小细胞肺癌具有明显的抑瘤及减毒增效作用[10-11],本研究以RNA干扰技术为切入点,研究结果显示消岩汤可协同Survivin siRNA使肺癌细胞凋亡率增加,揭示消岩汤对肺腺癌的治疗作用,从基因水平为中药复方抗肿瘤作用机制提供理论依据。
参考文献(略)
此文摘自:张 欣,贾英杰,杨佩颖.消岩汤对肺腺癌A549实体荷瘤小鼠肿瘤细胞凋亡干预机制的研究 [J]. 中草药, 2017, 48(11):2261-2266.
















