在国家食品药品监督管理总局(CFDA)公布临床数据核查意见的同一天,最高人民法院、最高人民检察院原则通过“临床试验造假入刑!”
作者 | 罗拉
来源 | "医学界"微信号
国家食品药品监督管理总局(CFDA)局长毕井泉有一个在医药圈流传的金句“做假数据,就是做假药!”2017年4月10日,CFDA、最高人民法院在同一天发布的两个重磅文件,让“假数据”“假药”有了文件法规阐释,同时也意味着临床数据造假行为,将面临的不再仅是行政处罚,更将承担刑事责任!
CFDA:怎样定义临床造假数据?
2017年4月10日,食品药监局(CFDA)发布了《总局办公厅再次公开征求《关于药物临床试验数据核查有关问题处理意见的公告(修改稿)》意见》。
CFDA在总结修改收到的280条反馈意见的基础上,按照法律法规要求,明确政策界限,严肃查处注册申请中临床试验数据造假行为,同时从实际出发,区别并非主观故意及其他客观情况影响判定的,给予补救措施,归纳出6项建议:
一、对于数据造假的行为,不列入漏报可能与临床试验用药相关的严重不良事件和漏报试验方案禁用的合并药物等情况。
二、对于药物临床试验数据造假的申请人在被处罚期间所涉及品种,如确属临床急需,可以提出特殊申请,国家食品药品监督管理总局组织专家论证后作出是否受理的决定。
三、对于数据造假所涉及的药物临床试验机构,由临床试验机构限期整改调整为所涉及专业限期整改。
四、对于数据造假所涉及的主要研究者,参与研究所有已受理的注册申请由不予批准调整为暂停审评审批。
五、对于数据造假涉及的品种,明确处理相关人员的程序,调整向社会公布和列入黑名单的内容。
六、对于处理及当事人的复议,增加相关内容,明确具体程序和途径。

最高检:临床数据造假入刑!
也在同一天,首席大法官、最高人民法院院长周强主持召开最高人民法院审判委员会全体会议,审议并原则通过《最高人民法院、最高人民检察院关于办理药品、医疗器械注册申请数据造假刑事案件适用法律若干问题的解释》。
《解释》送审稿规定:
1、药物非临床研究机构、药物或医疗器械临床试验机构、合同研究组织故意提供虚假的非临床研究报告、临床试验报告的,可以按提供虚假证明文件罪定罪处罚;
2、对于药品注册申请人自己弄虚作假,提供虚假的非临床研究或者临床试验报告及相关材料,骗取药品批准证明文件的,可以按生产、销售假药罪定罪处罚;
3、药物非临床研究机构、药物或医疗器械临床试验机构、合同研究组织与药品注册申请人共谋,提供虚假的非临床研究或者临床试验报告及相关材料,骗取药品批准证明文件,同时构成提供虚假证明文件罪和生产、销售假药罪的,以处罚更重的犯罪定罪处罚。
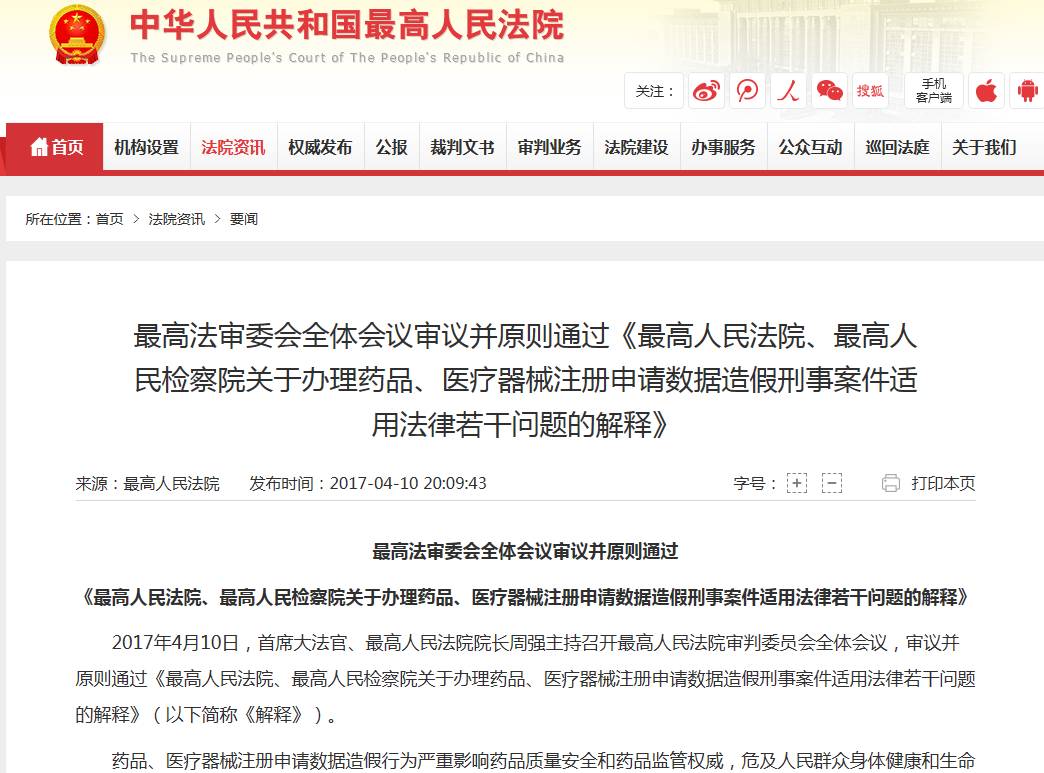
会议经讨论,原则通过该《解释》。会议决定,根据会议讨论意见对《解释》送审稿进行修改后,与最高人民检察院会签后适时发布。
迟来的刑事追责
其实在CFDA大力打击临床数据的路上,常见的处罚举措,诸如吊销证照、公开曝光、列入黑名单、3年不受理注册申请等,基本都属于行政处罚或者行政法律责任的范畴,刑事处罚则一直缺席,有业内人士分析,可能是因为刑事处罚起点太高,相关规定模糊。



据悉,医药行业违法犯罪行为的追究集中在《刑法》的一百四十一、一百四十二、一百四十五这三条。图片来自:中国医疗器械
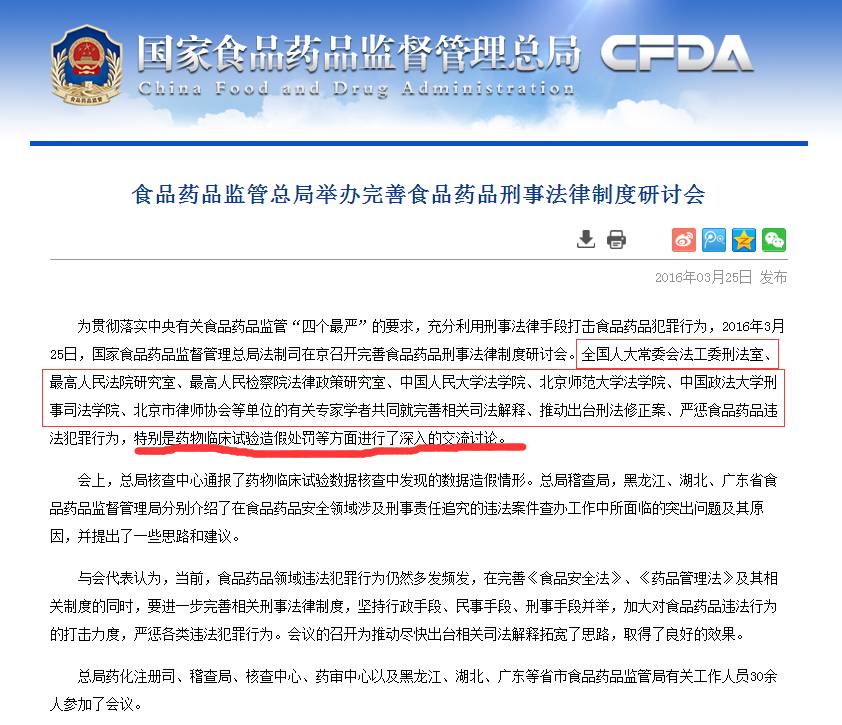
为此,在2016年3月25日,CFDA法制司曾在京专门召开了完善食品药品刑事法律制度研讨会,药物临床试验数据造假被特别点名通报,当时参与会的人员包括:全国人大常委会法工委刑法室、最高人民法院研究室、最高人民检察院法律政策研究室、中国人民大学法学院、北京师范大学法学院、中国政法大学刑事司法学院、北京市律师协会等单位的有关专家学者,可谓是阵容强大!
为何要出台追责法律?
2015年7月22日,CFDA发布了117号文件——《国家食品药品监督管理总局关于开展药物临床试验数据自查核查工作的公告》,开始了史上最严的临床数据核查风暴,紧接着,CFDA又紧锣密鼓地出台了一系列配套措施,公示了一批又一批的不合格药企、CRO,一时间,医药产业哀鸿遍野,据《北京商报》2016年6月报道,业内人士预测,在经历此轮政策洗牌后,国内近5000家企业将被压缩至2000家左右,一批生产能力和竞争力弱的企业将无生存空间。
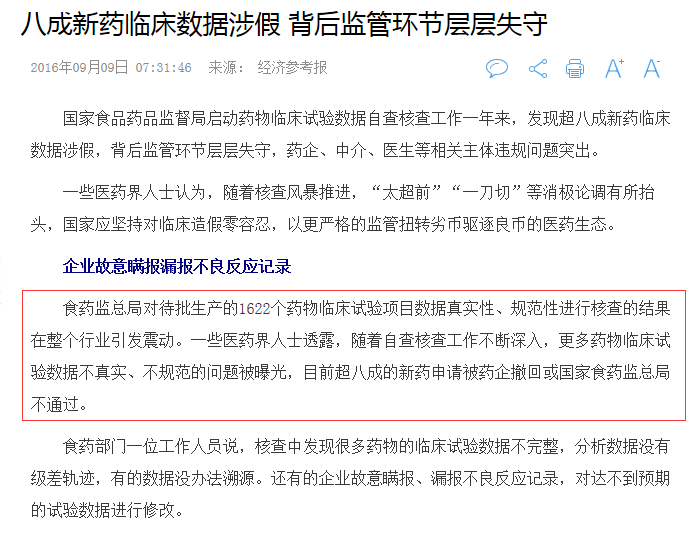
2016年9月,一篇《八成新药临床数据涉假,背后监管环节层层失守》的报道引起行业震动,该报道称:国家食品药品监督局启动药物临床试验数据自查核查工作一年来,发现超八成新药临床数据涉假,背后监管环节层层失守,药企、中介、医生等相关主体违规问题突出。
图片来自网络
这份报道的结论是基于一份CFDA披露的数据:
2015年7月22日,食药监总局发布公告,要求申请人对申请上市和进口的1622个注册申请的临床试验数据真实性、完整性、规范性进行自查,扣除免临床试验的品种193个,需要进行自查的品种共计1429个。申请人对临床试验存在问题的注册申请可以主动撤回,补充完善后重新申报。截至2016年6月底,企业经自查主动申请撤回了1193个,占应自查总数的83%。
虽然事后CFDA专门发文澄清事实,称“八成新药临床数据涉假”不符合事实,但是也有业内人士据此指出,临床数据造假泛滥可见一斑。

严厉打击临床数据造假行为,优化我国医药产业结构,遏制扭转市场上”安全无效仿制药“驱逐良药的态势,一条从仿制药大国转变为制药强国的规范之路,正在一步步被打造出来,而任何想要超车走捷径的行为,无疑会受到法律的严厉制裁。
本文综合整理自国家食品药品监督管理总局、最高人民法院。
版权申明 | 本文原创 欢迎转发朋友圈
投稿邮箱 | [email protected]
商务合作 | 021-58545118

▼过往的君子给我赞~

















