2017年,美国FDA批准了两款CAR-T细胞药物。同年12月11日,南京传奇CAR-T细胞药物的IND申请获得CDE受理,成为首个获得CDE受理的CAR-T细胞药物。
自南京传奇的申报获得受理算起,截止2018年6月底,CDE共受理了26个细胞治疗产品。
其中CAR-T占了23个,比例高达88%,在国内掀起一阵CAR-T旋风。
其实,细胞治疗产品的概念由来已久。1995年,FDA就受理了Genzyme申报的自体软骨细胞产品Carticel,并在两年后批准其上市。尽管目前FDA官网上查不到该产品的信息,根据小编掌握的信息推断,应该是企业出于市场销售因素的考虑自主退市。这个产品也是全球药审机构受理的受理细胞治疗产品。
细心的读者不禁要问,美国早在上个世纪就批准了细胞治疗产品,这中间的二十多年CDE在这方面都做了些什么。小编根据CDE官网的数据,整理了一张清单。该清单显示,
在南京传奇申报之前,CDE共受理了31个细胞治疗产品。
从受理号推断,首个申报发生在2001年,受理号为CSL01057,产品名称为抗原致敏的人树突状细胞,由第二军医大学免疫学研究所申报,正式受理时间为2002年1月8日,属于治疗用生物制品1类新药。最近的申请为3年前北京永泰生物制品有限公司申报的扩增活化的淋巴细胞,受理号为CXSL1500082,承办日期为2015年11月19日,属于治疗用生物制品3类新药。
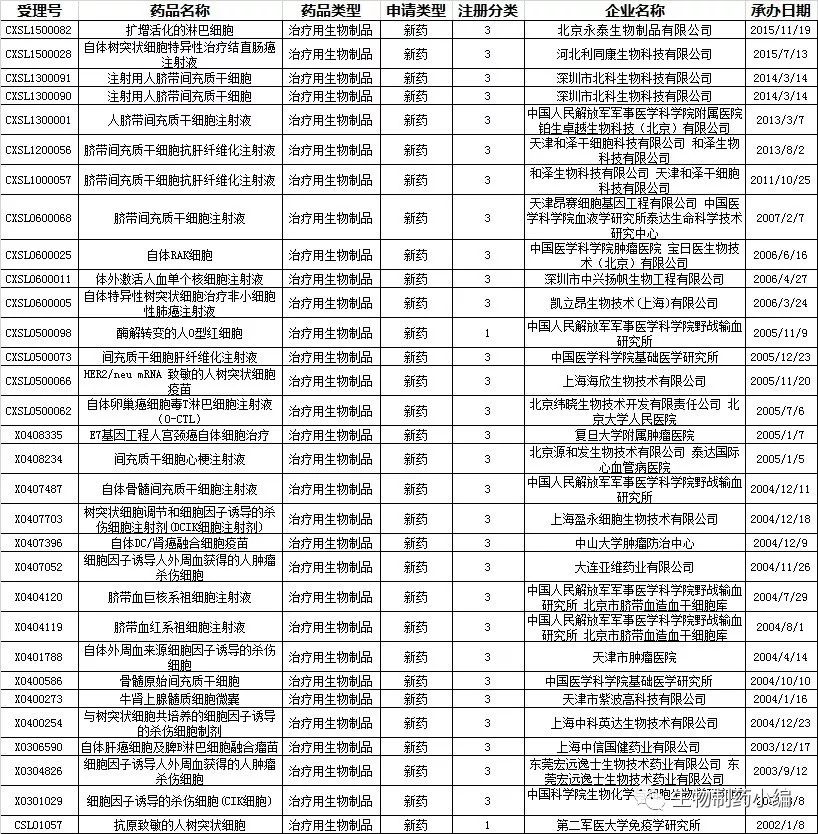
除了首个申报的抗原致敏的人树突状细胞,另一个
1
类新药为酶解转变的人
O
型红细胞,由军事医学科学院野战输血研究所申报。其余
29
个产品均为
3
类新药。自南京传奇的
IND
申报算起,
26
个细胞治疗产品中
24
个均为
1
类新药,只有复星凯特申报的
CD19 CAR-T
和北京三有利和泽生物申报的人牙髓间充质干细胞注射液属于
3
类新药。
从申报时间分布来看,24个申报发生在2006年以前,比例为77%。从2001年算起,到2016年的16个年份中,有7个年份的申报数目为0,3个年份的申报数目为1个。也就是说,10个年份的申报数目低于这段时间的平均水平(1.94个/年),比例为62.5%。其中,2004年申报的数目最多,高达12个,比例为39%。熟悉中国药品监管历史的读者会注意到,这个时间刚好跟郑筱萸主政国家食品药品监督管理局的任期重合。
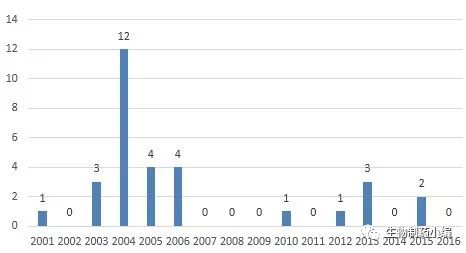
从申报单位地域分布来看,上海、北京、天津和广东省这四个地方最多,总计25个,比例为81%;河北省和辽宁省各占1席,达到全国平均水平;另外4个来自部队系统。从单位性质来看,这31个申报中,11个来自科研院所和医院,15个来自公司,还有5个为二者联合申报。其中,军事医学科学院申报了5个,中国医学科学院申报了4个,北科生物和和泽生物各申报了2个,其余单位均为1个。细胞药物属于新兴行业,在其发展的早期阶段,政府资助的项目研发占有重要地位。上海和北京拥有全国最好的教育和医疗资源,因此这两个地方几乎包揽了全国一半的申报也就不足为奇。
从申报单位地域分布来看,上海、北京、天津和广东省这四个地方最多,总计25个,比例为81%;河北省和辽宁省各占1席,达到全国平均水平;另外4个来自部队系统。从单位性质来看,这31个申报中,11个来自科研院所和医院,15个来自公司,还有5个为二者联合申报。其中,军事医学科学院申报了5个,中国医学科学院申报了4个,北科生物和和泽生物各申报了2个,其余单位均为1个。细胞药物属于新兴行业,在其发展的早期阶段,政府资助的项目研发占有重要地位。上海和北京拥有全国最好的教育和医疗资源,因此这两个地方几乎包揽了全国一半的申报也就不足为奇。
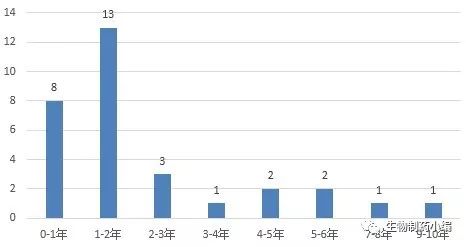
这部分,小编总结了前CAR-T时代中国细胞治疗产品受理的整体情况。接下来,小编将从产品类别入手,分析这31个产品的类型及特点。敬请关注!
文末彩蛋
“
2017生物制药小编精选文章汇编
”限量印刷150本,最后数本留给线上同仁,每本200元包邮,后台回复“汇编+微信号
”
,将有工作人员联系您,机会有限,先到先得。
欢迎加入小编团队成为小编一员
请加小编微信号:wuwenjun7237
如有技术解读、行业洞见愿意分享
欢迎投稿到小编邮箱:
[email protected]

欢迎个人转发分享。其他任何媒体、网站如需转载或引用本网版权所有内容须获得授权且在醒目位置处注明“转自:生物制药小编”。













