全球处方药市场在2016年的增长率达到6%,预计2022年将达到1万亿美元规模。2016年来自14家国际制药厂商的产品包揽了全球销售额TOP20,这些药物占据了10%的处方药市场,总值约为1280亿美元,所涉及的适应症包括癌症、糖尿病、炎性疾病,HIV和HCV。
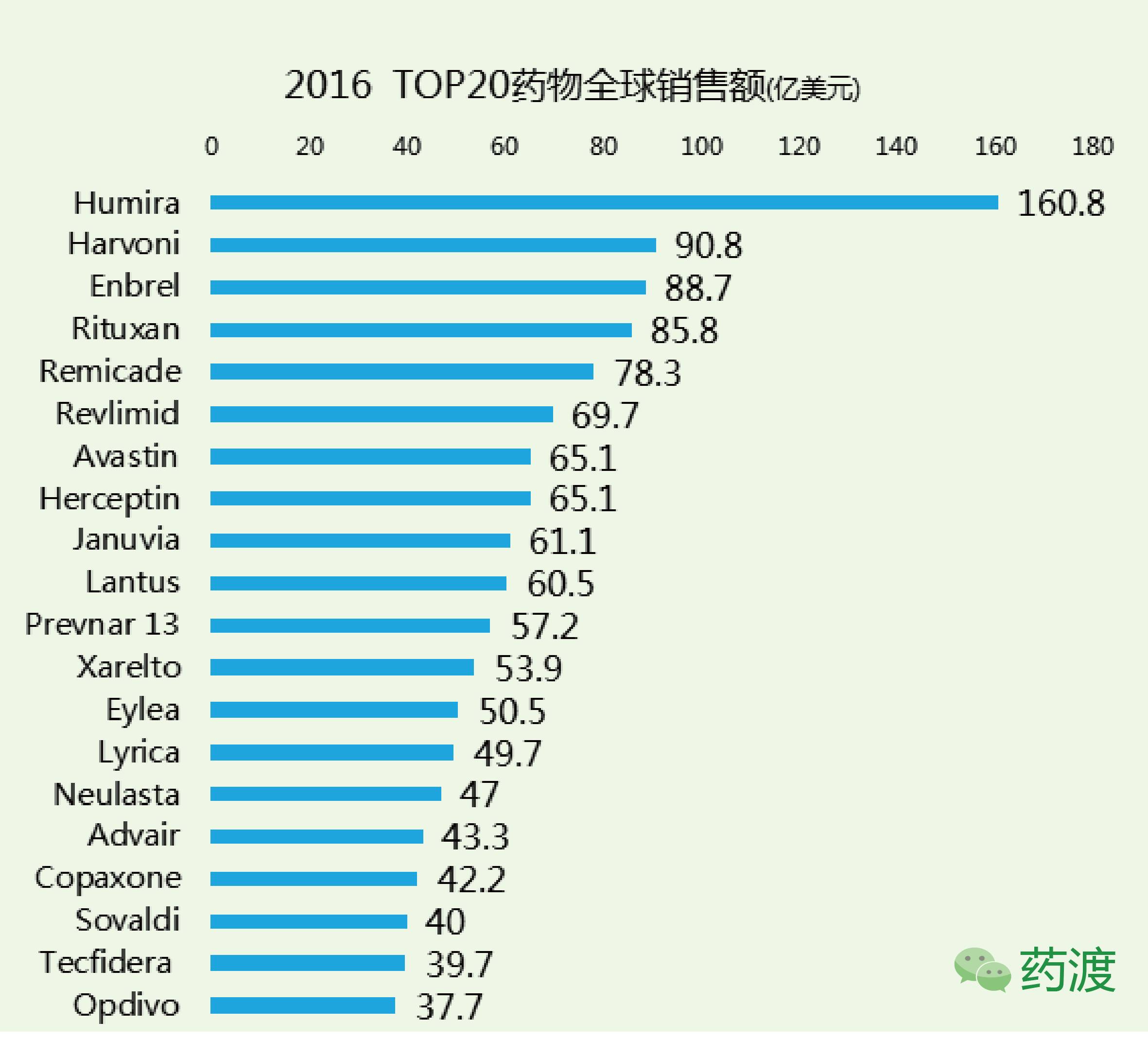
但是这样的局面应该不会持续很久,平均每年新上市45款药物以及大量仿制药物涌入市场都会在一定程度冲击现有重磅药的地位。
另一方面压力来自于政府,随着中国进入老龄化社会,人均就医次数的增加,在社保总量不变的前提下(当然,劳动力数量减少也是一部分原因),势必对单次医疗费用支付的上限造成很大限制,所以至少在中国,药品价格下降的可能性很大。
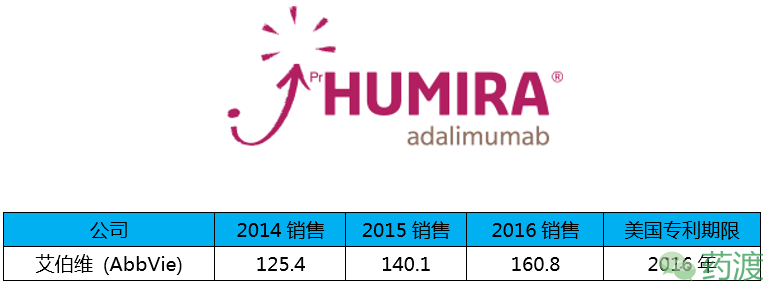
阿达木单抗(修美乐),由艾伯维(Abbvie)研发,于2002年12月31日获FDA批准,2010年2月26日获CFDA批准,商品名为Humira®。
阿达木单抗是一种全人源IgG1型单克隆抗体,通过与肿瘤坏死因子α (TNF-α)特异性结合,阻止TNF-α激活p55,p75细胞表面的TNF受体。该药批准的适应症包括类风湿关节炎、幼年特发性关节炎、银屑病性关节炎、强直性脊柱炎、成人克罗恩氏病、儿童克罗恩氏病、溃疡性结肠炎、斑块型银屑病、化脓性汗腺炎和非感染性中、后、全葡萄膜炎。
修美乐已在全球上市十余年,依然能够成为销售额第一,不得不让人佩服,但随着专利的到期以及大量仿制药的跟进,这种地位恐怕不保,2016年9月FDA批准首个修美乐仿制药上市——安进(Amgen)的Amjevita。
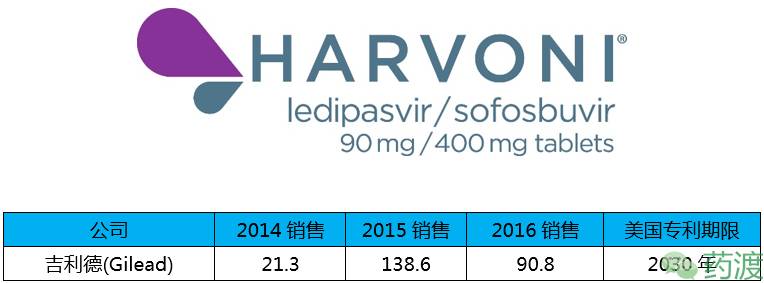
Harvoni® (Ledipasvir/Sofosbuvir)由吉利德公司研发,2014年10月10日获FDA批准上市,商品名为Harvoni®。该药是一种复方药,由ledipasvir与sofosbuvir(索非布韦)组成,被批准用于治疗基因1型丙型肝炎。Ledipasvir是一种丙型肝炎病毒NS5A抑制剂;而Sofosbuvir已于2013年首次获批上市,是一种丙型肝炎病毒核苷酸类似物NS5B聚合酶抑制剂。2017年4月7日FDA又批准该药用于治疗12到17岁青少年丙型肝炎。广泛的专利申请使该药品2015-2016年的盈利下降34%,但专利带来的好处会在之后体现出来。

依那西普由辉瑞和安进联合开发,于1998年11月2日FDA批准,2010年2月26日获得CFDA批准上市,由勃林格殷格翰在中国市场销售,商品名为Enbrel®。
依那西普是一种肿瘤坏死因子(TNF)阻断剂,能特异性结合于TNF分子,抑制TNF-α 和TNF-β与细胞表面TNF受体的结合。该药用于治疗类风湿性关节炎、多关节型幼年特发性关节炎、银屑病性关节炎、强直性脊柱炎和4岁及以上患者斑块状银屑病。

Rituximab(利妥昔单抗)由百健和罗氏联合研发,于1997年11月26日获得FDA批准,2008年4月21日获CFDA批准上市,并由百健和罗氏在美国、欧洲、日本和中国市场销售,商品名为Rituxan® 和MabThera®,随着专利的到期,许多仿制药陆续跟进,包括Genentech自己研制的二代药物Gazyva。
利妥昔单抗是一种靶向于CD20的人鼠嵌合型单克隆抗体,其与表达在B‑淋巴细胞表面的CD20抗原结合,通过补体依赖的细胞毒作用和抗体依赖的细胞毒作用杀伤肿瘤B细胞。该药批准的适应症主要为非霍奇金淋巴瘤、慢性淋巴细胞白血病、类风湿性关节炎。
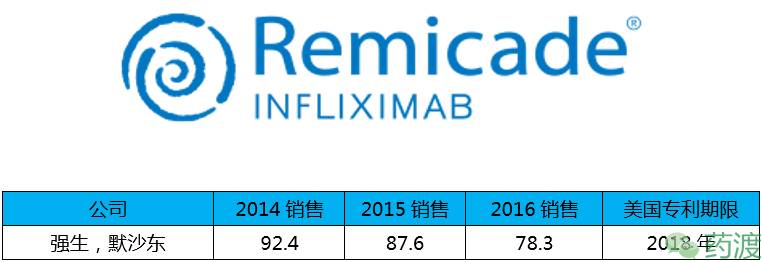
Infliximab(英夫利西单抗)由强生研发,于1998年8月24日获得FDA批准,2007年5月17日获得CFDA批准上市,商品名为Remicade®,2016年销售额下滑11%,2015年2月,公司丧失了该药在欧洲市场专销权,在持续受到仿制药的影响下,其销售数量和价格均被迫下降,未来该药物总销售额的下降已成定局。
英夫利西单抗是人鼠嵌合型单克隆抗体,作为一种肿瘤坏死因子(TNF)阻断剂,能以高亲和力结合到可溶性和跨膜形式的TNFα上并抑制TNFα与其受体的结合。该药批准的适应症为克罗恩氏病、溃疡性结肠炎、类风湿性关节炎、强直性脊柱炎、银屑病性关节炎、银屑病和白塞病。
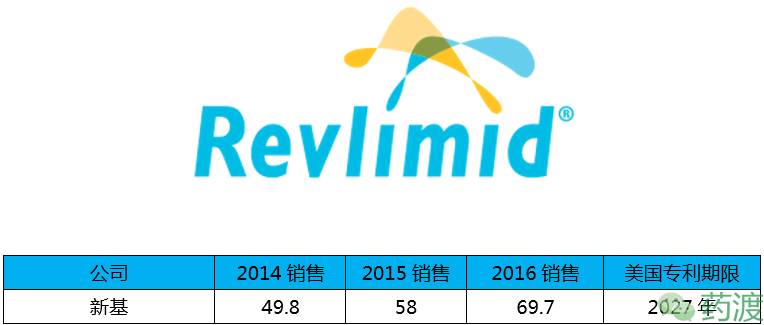
来那度胺由新基(Celgene)公司研发,2016年销售上涨近20%,目前依然是新基重要的产品,该药于2005年12月27日获FDA批准上市,商品名为Revlimid®。
来那度胺是沙利度胺类似物,具有免疫调节,抗血管生成和抗肿瘤特性。在多发性骨髓瘤细胞中,来那度胺和地塞米松协同作用,能够抑制细胞增殖,导致肿瘤细胞凋亡。该药与地塞米松联合使用,可用于治疗多发性骨髓瘤;也可用于治疗已接受过至少一种疗法,因有5q染色体缺失、存在或不存在其他细胞遗传学异常的低风险或中度风险的骨髓增生异常综合征所致的输血依赖型贫血,以及用于治疗已接受过包含一次硼替佐米疗法的两次治疗后的复发和进展性套细胞淋巴瘤。
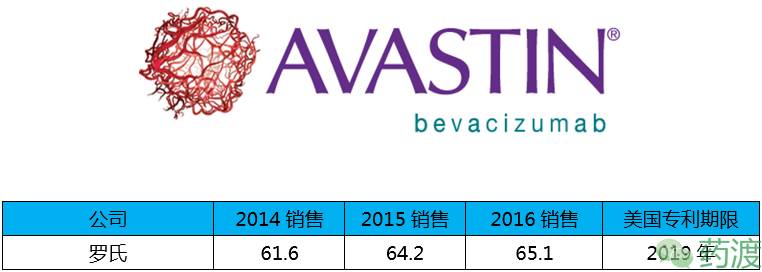
Bevacizumab(贝伐珠单抗)由罗氏研发,于2004年2月26日获得FDA批准,2010年2月26日获得CFDA批准上市,商品名为Avastin®,该药近几年在华销售情况良好。
贝伐珠单抗是一种人源化IgG1型单克隆抗体,能与血管内皮生长因子(VEGF)特异性结合,从而阻断VEGF与其在内皮细胞表面的受体(Flt-1和KDR)结合,以抑制肿瘤血管生成。该药批准的适应症为转移性结直肠癌、非鳞状非小细胞肺癌、宫颈癌、卵巢癌、转移性乳腺癌和恶性胶质瘤。
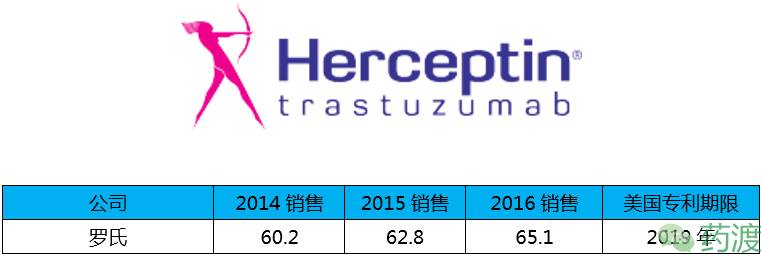
Trastuzumab(曲妥珠单抗)依然是罗氏的产品,于1998年9月25日获FDA批准,2002年9月5日获CFDA批准,商品名为Herceptin®,2016年销售增长约4%,主要原因是被纳入了中国医保目录。在美国,该药与Perjeta联用良好的临床效果也在一定程度上刺激了销售增长。
曲妥珠单抗是一种人源化IgG1κ型单克隆抗体,其与肿瘤细胞上的HER2结合并介导抗体依赖的细胞毒作用(ADCC)。该药用于治疗HER2过表达的乳腺癌患、HER2过表达的转移性胃癌或食管胃交界腺癌。
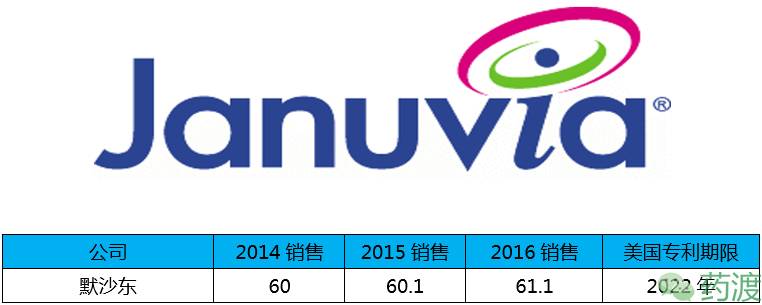
西他列汀由默沙东研发,于2006年10月16日获FDA批准上市,商品名Januvia®,2016年在美国,欧洲,加拿大的销售量良好,推动其总销售增加了1.58%,但在美国和欧洲却面临着价格压力。
磷酸西他列汀是二肽基肽酶-4 (DPP-4)的抑制剂,通过辅助饮食和运动改善成人2型糖尿病患者的血糖状况。

Insulin glargine(甘精胰岛素)由赛诺菲(Sanofi)研发,于2000年4月20日获得FDA批准,2003年11月7日获得CFDA批准,商品名为Lantus®,这款产品曾经是糖尿病领域销售第一的产品,当然仿制药也很多,默沙东、礼来、三星Bioepis均有相应的仿制计划。
甘精胰岛素是一种长效人胰岛素类似物,能刺激骨骼肌和脂肪组织对葡萄糖的摄取并抑制肝脏葡萄糖的生成,从而降低血糖。
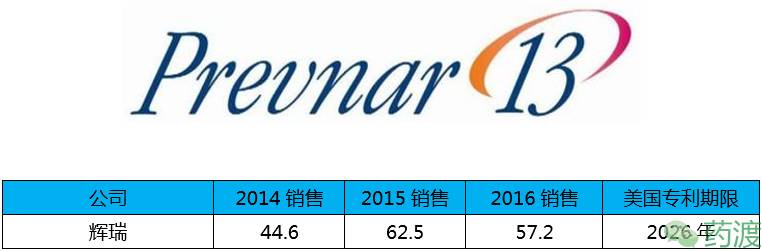
Prevnar 13肺炎球菌13价组合疫苗,由于该疫苗的高效,所以在上市之后(2014年第4季度上市)的销售下滑也在预期之内。
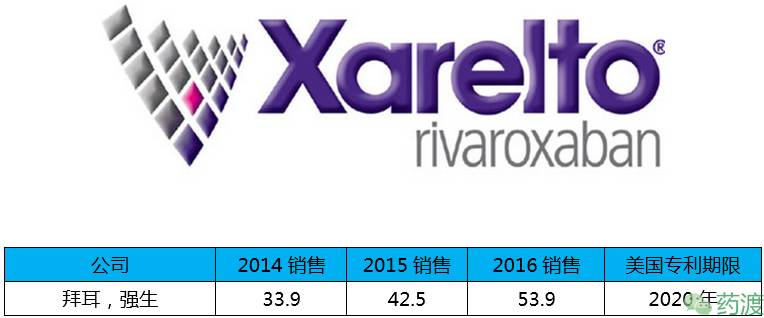
Rivaroxaban(利伐沙班)由拜耳和强生联合开发,于2011年7月1日获FDA批准上市,商品名均为Xarelto®,榜单中增长率最快的药物,达到27%,2016年销售额达到53.9亿美元。
利伐沙班是一种选择性凝血因子Xa抑制剂。它既能够抑制单独的凝血因子Xa,也能抑制结合在凝血酶原复合物上面的凝血因子Xa。利伐沙班对血小板聚集没有直接效果,但是对由凝血酶引起的血小板聚集有间接作用。通过抑制凝血因子Xa,利伐沙班降低凝血酶的生成。利伐沙班和阿司匹林单独或者加上氯吡格雷或噻氯匹啶共同来阻止成人心脏生物标志升高的急性冠脉综合症(ACS)和其后诱发的动脉粥样硬化症。
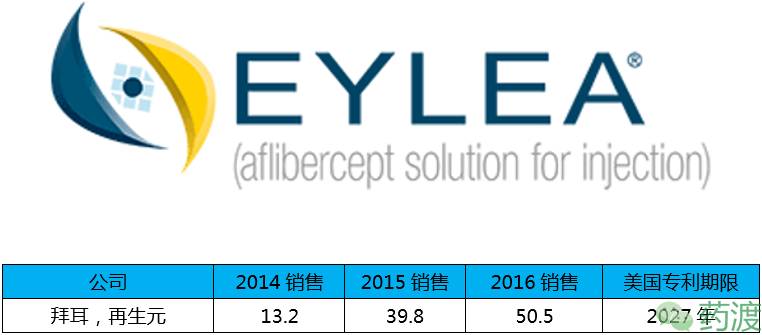
Aflibercept(阿柏西普)由再生元和拜尔联合研发,于2011年11月18日获得FDA批准,商品名为Eylea®,在美销售增长率达到24.2%,并将很快成为抗VEGF的市场领先品牌。
阿柏西普是一种融合蛋白,由血管内皮生长因子(VEGF)1型和2型受体部分胞外区和人IgG1 Fc区融合而成,能与VEGF-A和胎盘生长因子(PlGF)结合,从而抑制其结合和激活VEGF受体。该药批准的适应症为新生血管(湿性)年龄相关性黄斑变性、视网膜阻塞型黄斑水肿和糖尿病性黄斑水肿。
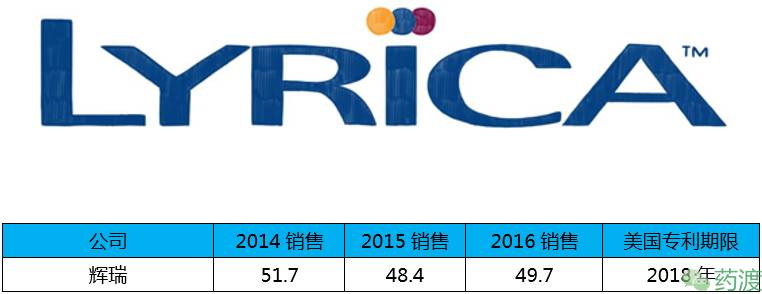
Pregabalin(普瑞巴林)由辉瑞研发,于2004年12月30日获FDA批准上市,商品名为Lyrica®,虽然该药专利将在2018年到期,但在这之前它依然能为辉瑞带来巨大利润。
普瑞巴林用于治疗糖尿病性外周神经病变(DPN)或脊髓损伤导致的神经疼痛,带状疱疹后遗神经痛(PHN)、纤维肌痛和癫痫发作。
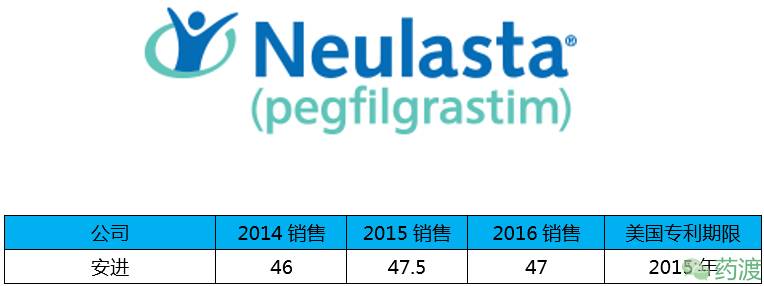
Pegfilgrastim(培非格司亭)由安进研发,于2002年1月31日获得FDA批准,商品名为Neulasta®,2015年销售47.5亿美元,2016年下降约1%,为47亿美元。
该药是一种聚乙二醇化的重组人粒细胞集落刺激因子,能调节骨髓中性粒细胞的产生,并影响中性粒细胞前体的增殖、分化和功能。该药用于治疗非髓性恶性肿瘤患者发热性中性粒细胞减少症。
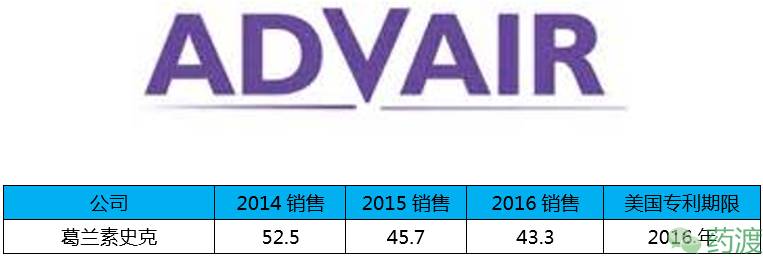
Advair(沙美特罗)用于长期常规治疗哮喘的可逆性呼吸道阻塞和慢性支气管炎,虽然专利在2016年就到期,但是Teva和山德士已经宣布放弃对该药的仿制,分析原因是沙美特罗是吸入式给药,需要专门的给药装置定量、准确地向患者肺部输送药物,较高的技术门槛导致仿制药物很难达到相似的生物等效性。
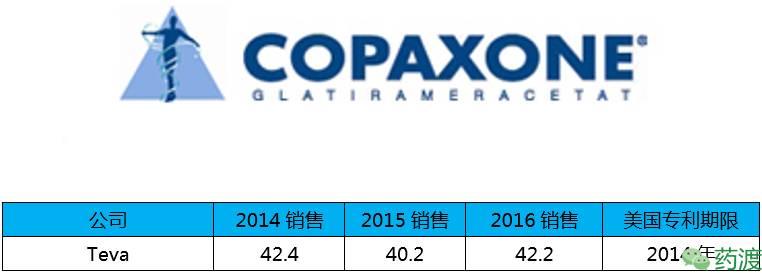
Glatiramer Acetate(醋酸格拉默),由L-丙氨酸、L-谷氨酸、L-赖氨酸和L-酪氨酸构成的无规则聚合物,一种在结构上与髓磷脂碱蛋白具有某些相似之处的肽类。该药用于降低非卧床、复发-缓解的多发性硬化的复发率,包括确诊的首次临床发作患者,认为有高风险进展为临床确诊的多发性硬化。尽管格拉默对多发性硬化作用的确切机制不明,但认为其调节了发病相关的免疫进程。
该药在2016年销售额占Teva当年销售的19%,为42亿美元,其中35亿美元是来自美国市场,该药从上市至今已经为Teva带来巨额收入。
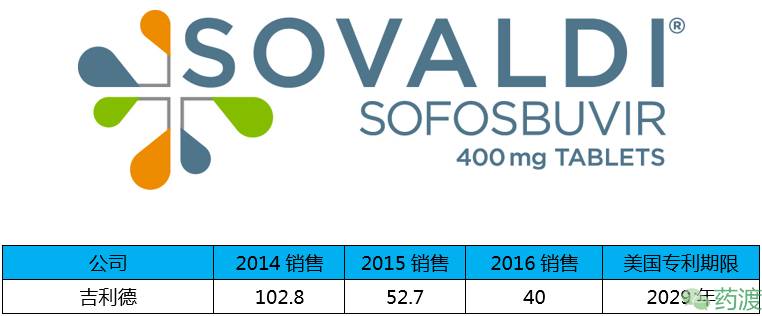
Sofosbuvir(索非布韦)由吉利德研发,于2013年12月6日获FDA批准上市,商品名为Sovaldi®。索非布韦是一种HCV NS5B RNA依赖型RNA聚合酶抑制剂,该聚合酶对病毒复制有重要作用。该药作为组合抗病毒治疗方案的一部分,用于慢性丙型肝炎感染的治疗。2017年4月7号FDA又批准该药用于治疗12到17岁青少年丙型肝炎。
该药是吉利德重磅药物,在2014年的销售额占市场的45%,2016年下滑至14%,在美销售19亿美元,欧洲8.91亿美元,在日销售6.35亿美元。

Dimethyl Fumarate(富马酸二甲酯)由百健研发,于2013年3月27日获FDA批准上市,商品名为Tecfidera®,销售额较前一年上涨9%,原因是价格的提升以及销售数量的提升,同样在全球新兴市场的成功上市也帮助其销售增长。
富马酸二甲酯治疗多发性硬化症的作用机制尚未完全清楚。一般认为富马酸二甲酯(DMF)降解成其活性代谢产物富马酸单甲酯(MMF),MMF上调核因子Nrf2通路,Nrf2通路与氧化应激应答有关。该药用于复发型多发性硬化症患者的治疗。
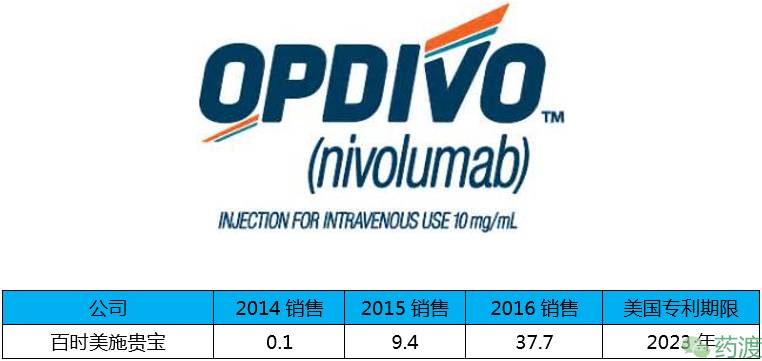
Nivolumab由小野制药和百时美施贵宝联合研发,2014年12月22日获得FDA批准,商品名为Opdivo®,近两年全球销售额激增,得益于不断扩大的适应症范围,该药是百时美施贵宝的主要产品,2016年该公司免疫肿瘤药物销售约为50亿美元,其中近38亿来自该药的销售。
Nivolumab是一种全人源单克隆抗体,作为程序性死亡受体1 (PD-1)阻断剂,能结合PD-1并解除PD-1通路对T细胞的抑制作用。该药批准的适应症为不可切除的或转移性黑色素瘤、晚期或转移性肾细胞癌、转移性鳞状细胞非小细胞肺癌、经典型霍奇金淋巴瘤、晚期或转移性尿路上皮癌、高微卫星不稳定性(MSI-H)或错配修复缺陷(dMMR)的转移性结直肠癌、处于铂类化疗期间或化疗之后的晚期转移性非小细胞肺癌和铂类化疗期间或化疗后疾病进展患者头颈部复发或转移性鳞状细胞癌。
参考来源: Top 20 Drugs in the World 2017