经常有人问,转录组、蛋白组学和代谢组我都测了,可是怎么结合起来能“物尽其用”呢?且往下看。
小编今天给大家分享一篇今年10月刚刚发表在CANCER LETTERS(IF:9.7)杂志上的文章,使用多组学数据研究右侧结肠癌肝转移相关代谢通路。

多组学分析揭示了右侧结肠癌肝转移的代谢通路
一.文章摘要
原发结直肠肿瘤可分为右侧结肠癌(RCC)和左侧结肠癌(LCC),其中RCC和LCC间的肿瘤细胞代谢有明显差异,阐明这一差异对结直肠癌研究至关重要。研究利用液相色谱-质谱法对32例RCC和58例LCC患者的肝转移(LM)样本进行非靶向代谢组学分析,并对患者的生物学特征差异进行了刻画。研究还对RCC及LCC患者进行了非靶向RNA测序和网络分析。结果研究发现RCC来源的LM患者生存率较低,且RCC中活性氧相关代谢物和胆汁酸增加。转录组学分析也发现RCC LM中MEK-ERK、PI3K-AKT和转录生长因子(EGFR)信号通路增加。总之,该研究通过多组学分析揭示了RCC和LCC细胞生理学上的几个关键差异,这可能与RCC和LCC肝转移间的临床差异有关。
二.文章的主要内容及结果
1.RCC及LCC的代谢组学分析
研究首先对LM和非转移(NL)患者样本进行了代谢组学分析。研究共纳入了32例RCC LM样本和58例LCC样本(表1A)。对两组样本的临床特征分析发现,其在年龄和性别方面无显著差异,且致病性KRAS突变状态也没有统计学差异。此外,研究对所有IV期肝转移患者进行生存分析,发现RCC LMs的生存率较低。接下来研究利用右-左(RL)指数比较了RCC和LCC原发肿瘤患者之间LM的标准化代谢谱,结果研究识别出了17种富集于RCC的代谢物以及11种富集在LCC中的代谢物(表2)。
表1 研究队列临床特征统计
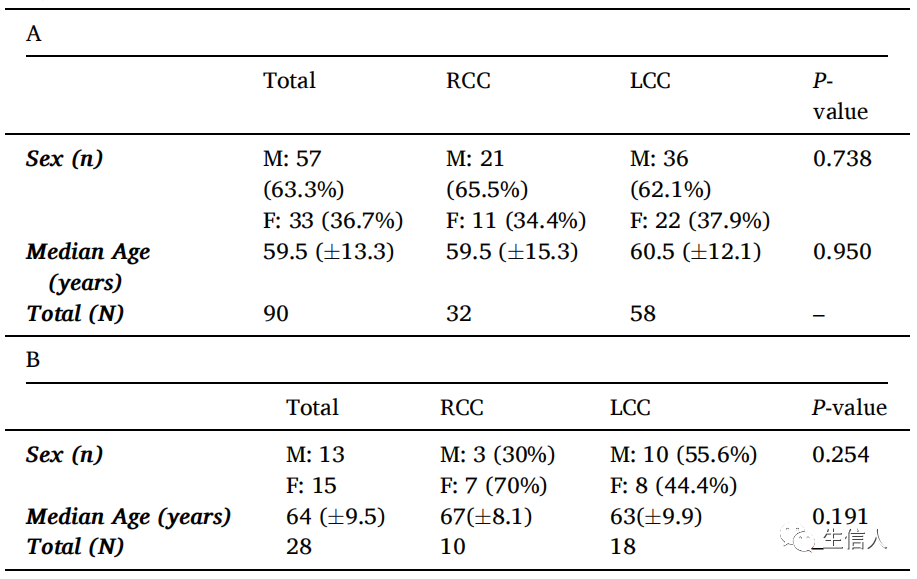
表2 RL指数测定的差异代谢物丰度
糖基脱氧胆酸在RCC中更高,因此研究进一步评估了所有胆汁酸的分布,结果发现了一种有利于RCC LMs的分布模式(图1A)。此外肉碱也被观察到富集于LCC,因此研究也评估了所有肉碱的RL分布,结果发现了有利于LCC LMs的肉碱分布模式(图1B)。
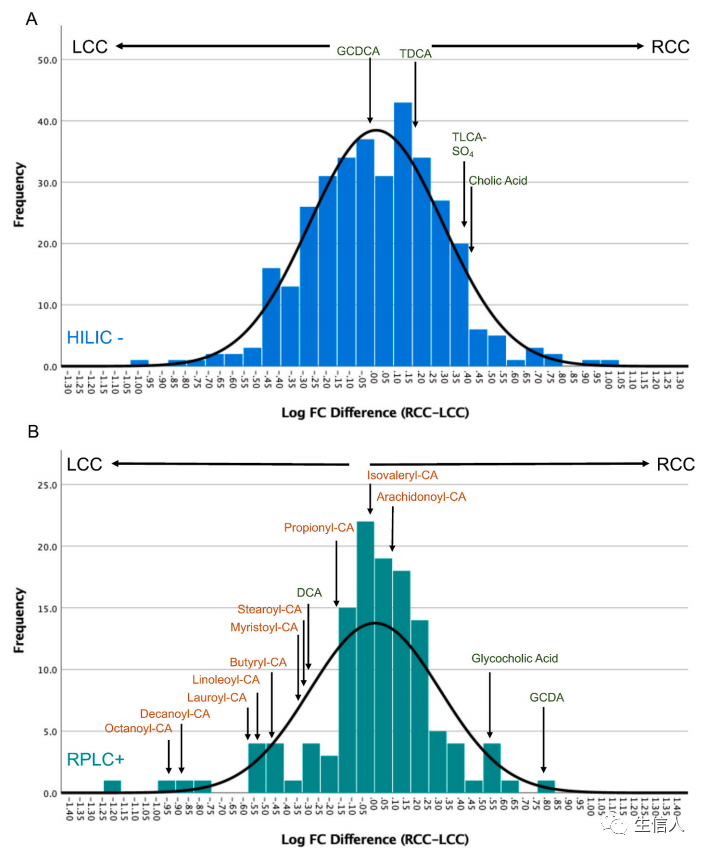
图1 胆汁酸和肉碱的RL分布
2.RCC和LCC的转录组分析
作者接着基于转录组数据对RCC和LCC的表达及相关通路进行了分析。研究首先通过比较10名RCC患者和18名LCC患者LMs样本的转录组数据,对差异表达基因进行了分析(表1B,图2)。
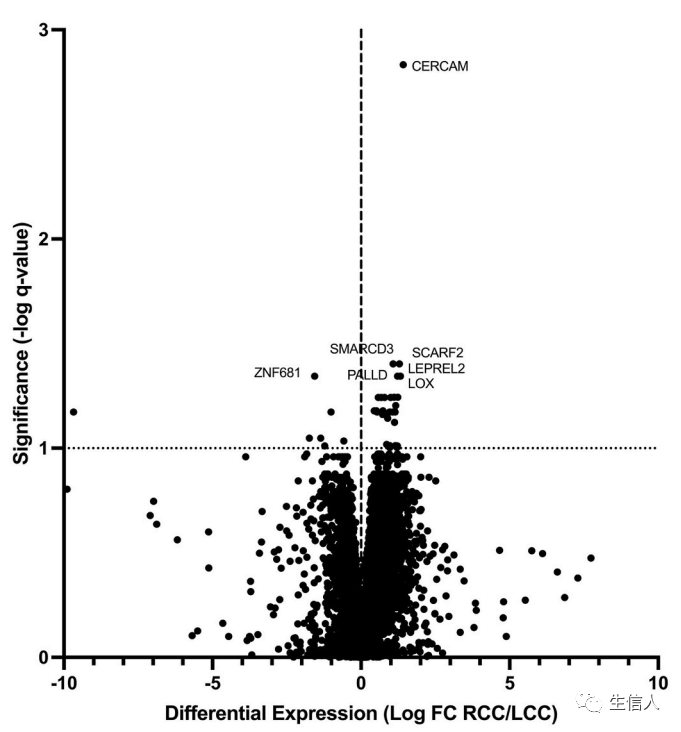
图2 RCC和LCC的差异表达分析
接下来研究利用IPA软件对RCC LMs与LCC LMs间显著差异基因涉及到的通路进行分析,并预测了这些差异基因的上游调控因子,进一步构建了相关网络(图3),结果发现MAPK、ERK、AKT、PI3K和TGF-β是连接最紧密的节点。此外研究也观察到PI3K-AKT和MEK-ERK通路显著上调,这两种通路是EGFR下游效应通路。最后,研究观察到TGF-β在预测网络中发挥核心作用,它也被观察到在RCC中高度上调。
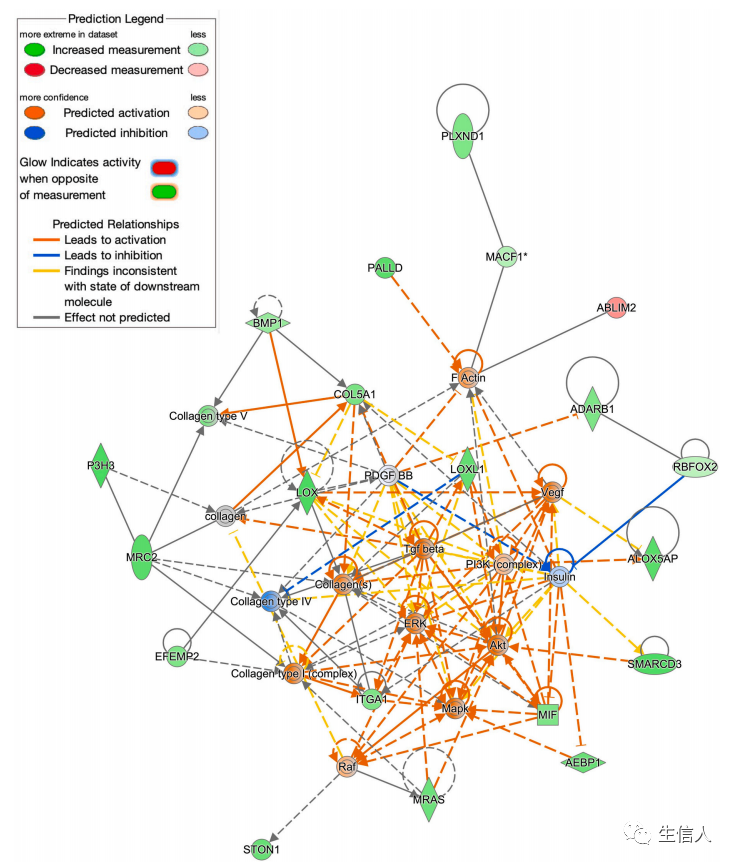
图3 差异基因的IPA网络分析
3. RCC及LCC的免疫组织化学分析
在文章的最后一部分,研究通过RCC及LCC样本的免疫组化(IHC)分析,对上述结果进行了验证。研究发现TGF-β和CERCAM在RCC组织中的表达高于LCC组织,这与上述代谢及转录数据分析结果一致(图4)。
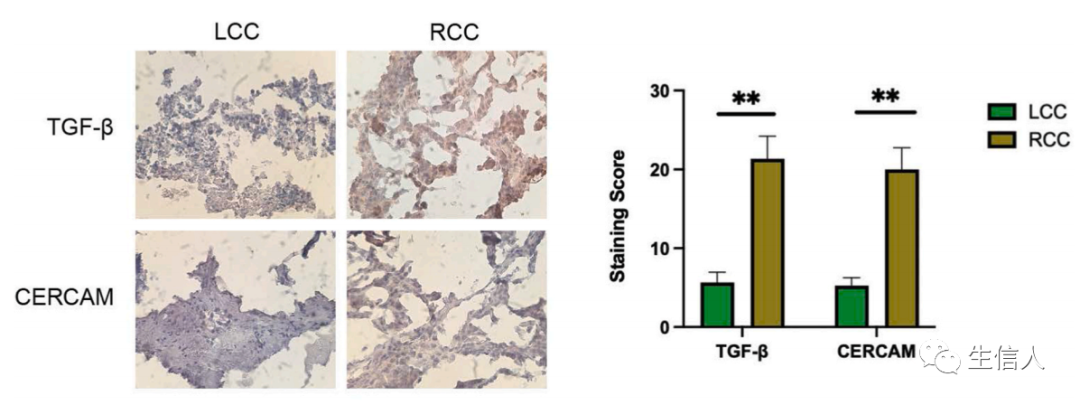
图4 RCC和LCC肝转移中TGF-β和CERCAM的免疫组化
综上所述,作者总结出了RCC LM致病及EGFR耐药的潜在机制:RCC相比于LCC活性氧(ROS)和胆汁酸丰度增加,脂肪酸氧化(FAO)下调,此外RCC LM中TGF-β增加,MEK-ERK和PI3K-AKT信号增加。这些结果表明侧边性是RCC及LCC差异的独立驱动因素,这也为研究转移性RCC的不良预后及EGFR抑制抗性机制提供了参考(图5)。
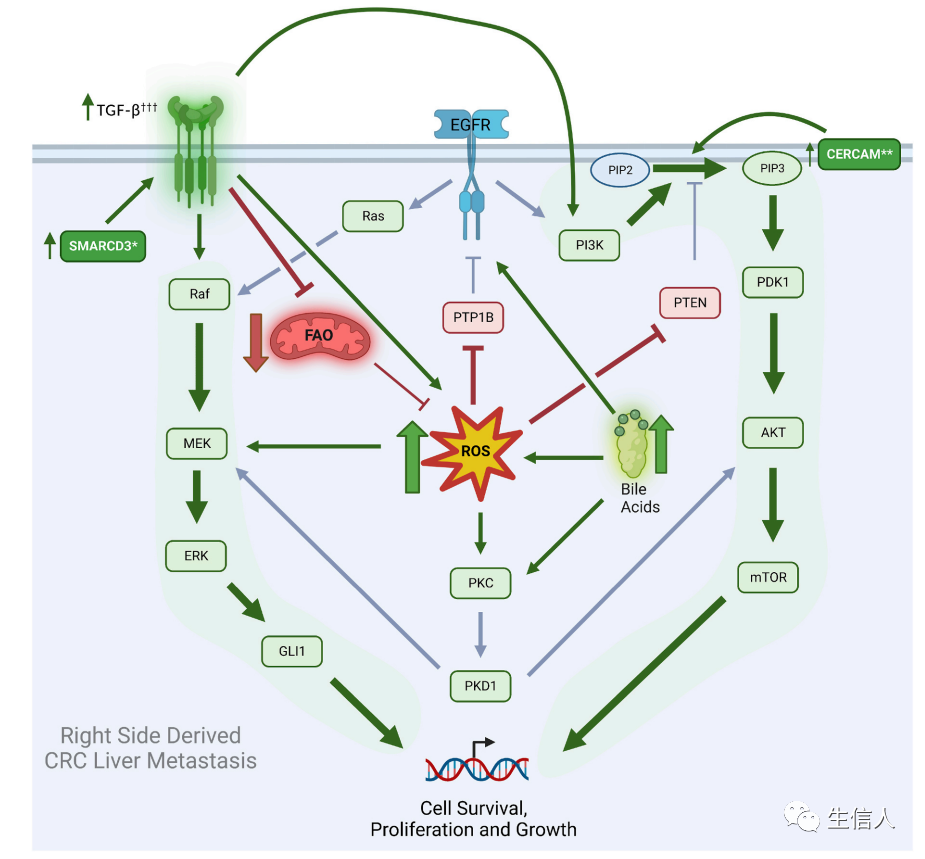
图5 RCC LM致病及EGFR耐药的潜在机制
小结
到这里这篇文章的主要内容就介绍完了,文章聚焦于RCC及LCC肝转移差异,利用多组学数据对RCC及LCC肝转移的代谢及转录差异进行了分析,并利用免疫组化对分析结果进行了验证。文章内容简洁,逻辑清晰,简单易懂,十分适合参考学习。所以,也没有那么复杂对不对?想盘活手里的转录组、蛋白组和代谢组数据,比文章内容更进一步分析的小伙伴,赶紧联系我们吧。















