2020年11月29日,加科思药业港股发布聆讯后资料文件,预计不久后将在港股上市。

加科
思
是一家临床阶段制药公司,专注于创新肿瘤疗法的自主发现和开发。在开发临床
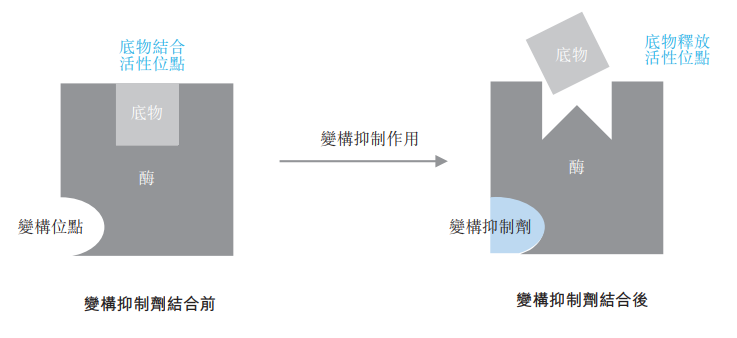
阶段小分子候选药物,通过结合变构位点(即催化化学反应的活性位点以外的位点)来
调节酶以应对缺少容易成药且允许药物结合的口袋的靶点(如蛋白酪氨酸磷酸酶(PTP)
和Kirsten大鼠肉瘤2病毒癌基因同源物(KRAS))方面,
加科
思
于2015年7月成立
。
拟积极寻求及建立与领先跨国公司(MNC)的战略和协作伙伴关系,例如
加科
思
与AbbVie有关创新变构含Src同源2结构域磷酸酶-2 (SHP2)抑制剂的合作。
该等合作汇
集了互补的专业知识和资源,以增加
加科
思
候选药物的成功几率,确保在全球范围内最
大程度实现其临床和商业价值。
领先药物开发项目包括两个临床阶段的变构SHP2抑制剂(JAB-3068及
JAB-3312)。
JAB-3068为第二个获得美国FDA研究用新药(IND)批准进入
临床开发的SHP2抑制剂候选药物。
已在中国完成JAB-3068 I/IIa期试验的I
期剂量探索部分及于美国完成I期试验剂量递增小组患者入组。
截至2020年7月
24日,在美国I期试验中,中期结果显示按不超过每日300 mg的剂量(150mg BID
(即每日两次)或300mg QD(即每日一次))接受JAB-3068治疗的32名患者治疗组
中并未出现明显不良事件。
每日300mg剂量组中的11名患者中的7名疾病稳定
(SD),疾病控制率(DCR)为63.6%。
既往接受过PD-(L)1治疗的每日300mg剂量
组
的8名患者中,五名患者(62.5%)达到SD,且该五名患者均为既往PD-(L)1治疗
后疾病进展。中国临床I/IIa期试验的剂量递增阶段中显示的JAB-3068安全性与美
国研究相似。
本研究积极的安全性结果支持JAB-3068在临床IIa期中的进一步评
估。
目前正在中国临床IIa期中评估JAB-3068对三类实体瘤的临床疗效。
截
至2020年7月24日,在26名患者中,1名患者达到未确认的部分缓解(PR),8名
患者达到SD,DCR达到34.6%。
11名接受过PD-(L)1治疗的患者中,有4名患者
达到SD (36.4%)。
正在中国及美国临床I期试验中评估JAB-3312。
美国I期
试验的初始安全数据支持按不超过8mg QD剂量使用JAB-3312。
截至2020年7月
24日,在12名可评估患者中,6名患者(50%)达到SD,DCR为50%。
2020
年7月招募了中国试验的首名患者,并预计于2020年底公布此试验的初步主要数
据。
加科思产品线
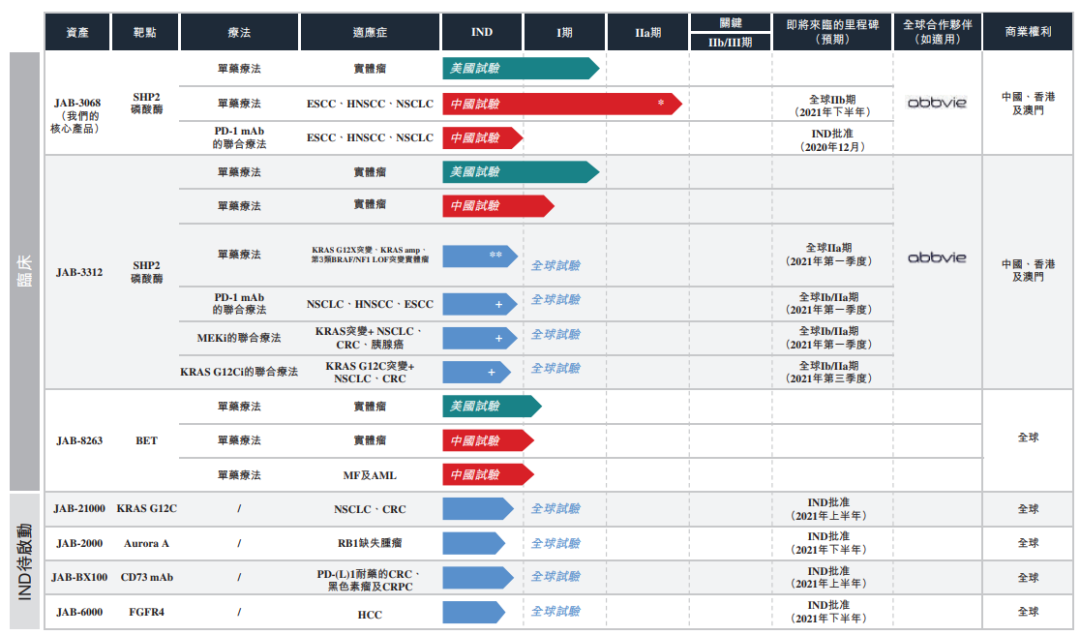
来源于:加科思
招股书
创新变构KRAS抑制剂JAB-21000旨在以KRAS G12C突变为靶点。预
计于2021年上半年向美国FDA及国家药监局提交JAB-21000的IND申请。
在
内部头对头临床前动物研究中,JAB-21000表现出杰出的药代动力学(PK)特性
和良好的耐受性,并且与安进及Mirati正在临床开发中的KRAS G12C抑制剂(
基于已公布的分子结构内部合成)相比具备杰出的剂量特性潜力。
加科思于2020年5月29日与AbbVie
订立许可与合作协议
(经修订并于2020年7月31日生效),以研发和商业化若
干SHP2抑制剂(「SHP2抑制剂」),包括JAB-3068及JAB-3312,以及用于任何适应症
的含有该等SHP2抑制剂的产品。
根据AbbVie协议,
我们已授予AbbVie我们若干专利及专有技术项下的全球、独家、可转授许可,以研

















