兴证医药团队(徐佳熹/孙媛媛/赵垒/杜向阳/霍燃/张佳博/黄翰漾)
国内医药行业正处变革转型的新时期,新药、新技术实现从0到1的突破很大程度向国外前沿领域看齐,因此海外生物医药的新动态对于国内相关领域的发展方向具有良好的示范和引导作用。为此,兴证证券医药团队专门推出最新力作——立足新技术、新视野的海外一周精华资讯汇总,欢迎各位投资者鉴阅!
海外重磅新闻
美国FDA授予安进新型降脂药Repatha优先审查资格,纳入降低主要心血管事件风险
美国生物技术巨头安进(Amgen)近日宣布,FDA已授予PCSK抑制剂类降脂药Repatha(evolocumab)一份补充生物制品许可(sBLA)优先审查资格,其审查周期将由常规的10个月缩短至6个月。如果获批,Repatha在美国的处方信息将更新,纳入来自大型心血管预后研究FOURIER中Repatha降低主要心血管事件风险的数据。FDA已指定该sBLA的处方药用户收费法(PDUFA)目标日期为2017年12月2日。与此同时,FDA也受理了Repatha第二个申请,该申请寻求扩大Repatha的降脂适应症,纳入更多的患者人群。
强强联手!默沙东与阿斯利康达成总额85亿美元的全球肿瘤学战略合作
英国制药巨头阿斯利康(AstraZeneca)近日宣布与美国制药巨头默沙东(Merck & Co)达成一项全球性的肿瘤学战略合作,共同开发和商业化阿斯利康的靶向药物PARP抑制剂Lynparza(olaparib)用于多种类型癌症的治疗。另外,这两家公司将分别进行LYNPARZA同各自PD-L1药物IMFINZI (durvalumab)和PD-1抑制药物KEYTRUDA (pembrolizumab)的联合用药研究并各自进行商业化推广。双方同时将共同开发并商业化阿斯利康制药的口服强效选择性MEK抑制剂selumetinib(司美替尼)。
欧盟批准治疗慢性阻塞性肺病(COPD)的首个三合一疗法Trimbow (ICS/LABA/LAMA)
意大利凯西制药集团(Chiesi Group)近日宣布,欧盟委员会(EC)已批准呼吸药物Trimbow(ICS /LABA /LAMA)用于接受ICS /LABA组合方案无法充分控制病情的中度至重度慢性阻塞性肺病(COPD)成人患者的维持治疗。Trimbow是首个超细(extrafine)三合一复方吸入剂,由一种吸入性糖皮质激素(ICS)、一种长效β2受体激动剂(LABA)、一种长效毒蕈碱拮抗剂(LAMA)组成。
欧盟批准一款新的高钾血症治疗药物Veltassa
欧盟委员会(EC)近日批准了来自Vifor Pharma公司的一款新的钾离子结合剂Veltassa,用于高钾血症(hyperkalaemia)成人患者的治疗。高钾血症是指血液中钾离子水平升高,如果不及时治疗,可导致心悸、肌肉疼痛、肌肉无力、麻木、心律异常。Vifor预计于今年底或明年初将Veltassa推向整个欧洲市场。
FDA批准首个乳腺癌延长辅助疗法Nerlynx,降低早期HER2阳性乳腺癌复发风险
美国生物技术公司Puma近日宣布,美国食品和药物管理局(FDA)已批准Nerlynx(neratinib,来那替尼)用于HER2阳性早期乳腺癌成人患者的延长辅助治疗。值得一提的是,Nerlynx是首个获批用于这一类型乳腺癌的延长辅助疗法,该药是一种每日口服一次的酪氨酸激酶抑制剂(TKI),适用于既往已接受罗氏靶向抗癌药赫赛汀(Herceptin,通用名:trastuzumab,曲妥珠单抗)辅助治疗的HER2阳性早期乳腺癌患者的延长辅助治疗。Puma公司已计划在今年9月将Nerlynx推向美国市场。目前,Nerlynx也正在接受欧洲药品管理局(EMA)的审查。
梯瓦哮喘新药Cinqaero获英国NICE批准
以色列制药巨头梯瓦(Teva)呼吸新药Cinqaero(reslizumab)近日在英国监管方面传来喜讯,英国医疗成本监管机构——英国国家卫生与临床优化研究所(NICE)已发布一项最终评估决定(FAD),推荐将Cinqaero用于国家服务系统(NHS),作为一种附加疗法,用于接受高剂量吸入性糖皮质激素及其他药物进行维持治疗但病情控制不佳的重度嗜酸性粒细胞性哮喘成人患者的治疗。

葛兰素史克皮下注射剂型狼疮药Benlysta获美国FDA批准
英国制药巨头葛兰素史克(GSK)近日宣布,美国食品和药物管理局(FDA)已批准皮下注射剂型(SC)Benlysta(belimumab,贝利木单抗),用于正在接受标准治疗的活动性、自身抗体阳性系统性红斑狼疮(SLE)成人患者。SLE是最常见的狼疮类型,约占全部狼疮病例的70%,这是一种慢性、无法治愈的自身免疫性疾病,患者体内产生自身抗体攻击机体任何一个组织。此次批准,也标志着治疗SLE的首个皮下注射药物获批。
新药研发进展
葛兰素史克向欧盟提交哮喘药物Relvar Ellipta扩大应用申请
英国制药巨头葛兰素史克(GSK)近日宣布,已向欧洲药品管理局(EMA)提交了呼吸药物Relvar Ellipta(fluticasone furoate/vilanterol, FF/VI,糠酸氟替卡松/维兰特罗)的一份监管申请文件,扩大该药的适用范围,用于接受ICS/LABA组合方案已充分控制病情的哮喘患者。
阿斯利康Imfinzi/tremelimumab免疫组合一线治疗转移性非小细胞肺癌(NSCLC)III期临床失败
英国制药巨头阿斯利康(AstraZeneca)近日公布了PD-L1免疫疗法Imfinzi (durvalumab)一线治疗转移性(IV期)非小细胞肺癌(NSCLC)的III期临床研究MYSTIC的初步数据。研究中,患者PD-L1表达状态采用伴随诊断试剂盒VENTANA PD-L1(SP263)进行检测确定,研究的主要终点是无进展生存期(PFS)和总生存期(OS)。
优时比向美欧提交抗炎药Cimzia治疗银屑病新适应症申请
比利时制药巨头优时比(UCB)和合作伙伴Dermira近日宣布,已向美国食品和药物管理局(FDA)提交了抗炎药Cimzia(certolizumab pegol)的一份补充生物制品许可(sBLA),同时已向欧洲药品管理局(EMA)提交了一份监管申请文件,这2份申请文件寻求扩大Cimzia的适应症,纳入治疗中度至重度斑块型银屑病成人患者。此外,双方也已向加拿大卫生部(Health Canada)提交了Cimzia用于该患者群体的额外申请。
西雅图抗癌药Adcetris获加拿大批准用于霍奇金淋巴瘤患者干细胞移植后的巩固治疗
西雅图遗传学公司(Seathle Genetics)近日宣布,加拿大卫生部(Health Canada)近日已授予抗体药物偶联物(ADC)Adcetris(brentuximab vedotin)无条件批准,用于接受自体干细胞移植(ASCT)后具有升高的复发或进展风险的霍奇金淋巴瘤(HL)患者的巩固治疗。在加拿大,Adcetris之前已获有条件批准,用于2个淋巴瘤适应症:(1)接受ASCT后病情复发或接受治疗2种多药化疗方案后病情复发且不适合ASCT的HL患者;(2)接受至少一种多药化疗方案后病情复发的系统性间变性大细胞淋巴瘤(sALCL)患者。
前沿科学研究
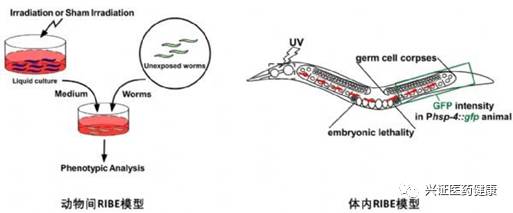
Nature:薛定组揭示介导放射线诱导旁观者效应的关键因子
2017年7月19日,清华大学生命学院薛定研究组在《自然》(Nature) 杂志上在线发表了题为《组织蛋白酶B介导放射线诱导的旁观者效应》 (Cysteine protease cathepsin B mediates radiation-induced bystander effects) 的研究论文, 首次在动物模型上系统地揭示了介导radiation-induced bystander effects (RIBE;放射线诱导的旁观者效应)的关键因子及作用机制。
Cell:科学家发现增强干扰素抗病毒效应新分子新机制
中国工程院院士、中国医学科学院院长曹雪涛团队日前发现,甲基转移酶分子SETD2能够显着增强干扰素的抗病毒效应,促进机体抵抗病毒能力,提高干扰素疗法清除乙肝病毒效果。该发现为抗病毒免疫应答效应机制提出了新观点,也为有效防治病毒感染性疾病提供了新思路。相关成果发表于新一期《细胞》杂志。
Cell:研究人员证实具核梭杆菌促进结直肠癌化疗耐药性产生机制
7月27日,来自上海交通大学医学院附属仁济医院消化科的房静远教授、陈萦晅副教授、洪洁和陈豪燕副研究员以及美国密西根大学邹伟平教授在《Cell》期刊上联合发表了一项研究。研究表明,肠道中的具核梭杆菌可以阻止化疗引起的癌细胞凋亡过程,与结肠直肠癌的复发和预后不良有关。