最近频频发布的各种与肥胖相关的研究,让不少读者表示感受到了深深的恶意……呃,喝凉水都能长肉的奇点糕也是感同身受,每次想美餐一顿的时候,都要表达对那些怎么吃都不胖的人们的羡慕嫉妒恨。
每年9月将尽,都是闻名于世的慕尼黑啤酒节举办的日子,不知有多少大啖猪腿与啤酒的德国人也有着和奇点糕一样的忧伤呢?不过,9月22日的《细胞-代谢》(Cell Metabolism)上发表的最新研究成果,也许会让这样的烦恼烟消云散。慕尼黑工业大学的研究人员设计了一种将糖皮质激素与肠促胰岛素结合使用的新型减肥药,在小鼠实验中仅用两周就高效减重25%,同时还避免了激素带来的诸多副作用[1]!

大吃之前,还是要掂量掂量
为什么这种新药能够效果如此之好?那就要从肥胖和炎症的关系说起了。随着科研探索不断深入,代谢失调导致的慢性炎症反应在肥胖形成过程中的作用也逐渐受到重视[2],通过复杂的信号通路,炎症反应可以累及全身多处组织器官,促进肥胖的形成[3]。虽然具体机制探索还远未明朗,但已有研究显示下丘脑在其中起着重要的调节作用[4]。
既然炎症反应作用重要,那么使用药物控制炎症,不就能实现治疗肥胖的目的?而临床最常用的抗炎药物大概就是糖皮质激素了。通过阻断炎症介质形成、抑制细胞因子和黏附分子的产生、诱导炎症细胞凋亡等多种机制,糖皮质激素可以发挥强大的抗炎作用,因此常用于严重感染,还因其免疫抑制作用用于自身免疫性疾病、血液系统疾病等众多疾病的治疗。医生们口中的“激素”,一般说的就是糖皮质激素。
那么把糖皮质激素用到肥胖治疗上不应该是理所应当的吗?可惜,事情并不像1+1=2那么简单。作为人体内重要的激素之一,糖皮质激素对体内蛋白质、糖、脂肪、水和电解质代谢都有着显著影响,可产生血糖升高、骨和肌肉内的蛋白质分解、脂肪重新分布等多种作用,因此其使用会产生骨质疏松、水肿、向心性肥胖(脂肪集中分布在躯干)等许多副作用[5],虽然对于病情危重和没有其他治疗选择的患者而言,副作用是必须接受的代价,但对于肥胖患者来说,可能就难以接受了。
单独应用不行,那么结合用药呢?本次论文的通讯作者Brian Finan和Matthias Tschöp两位教授带领的研究团队一直在探索借助化学载体,实现激素靶向送抵特定靶细胞的方式,早在2012年就实现了将肠促胰岛素GLP-1与雌激素结合,“精准打击”缓解代谢异常,而且这种方法还避免了雌激素导致的副作用。

论文的通讯作者Tschöp(左)和Finan(右)教授
同一次实验中,研究人员还发现GLP-1在下丘脑及肝脏等主要的代谢器官有着显著的高表达,因此当时就提出以GLP-1作为载体,发挥糖皮质激素在代谢疾病中的抗炎作用[6]。而研究显示,GLP-1在外周免疫细胞中也有表达并发挥重要作用[7],这就意味着GLP-1与糖皮质激素结合使用对炎症反应的调节范围可以进一步扩大。
有着成功经验打底和良好前景呼唤,本次的试验可以说是驾轻就熟。试验选择的糖皮质激素是最为常用和廉价的地塞米松(Dexamethasone),在使用化学方式制备出稳定的GLP-1-激素结合物(GLP-1/Dexa)后,研究人员对饮食诱导的肥胖小鼠进行了为期两周的结合物注射(100nmol/kg)。与空白对照组相比,结合物注射组小鼠的体重两周之内下降了25%,效果是注射同样量的非结合GLP-1和地塞米松组的一倍,进一步的分析显示,小鼠减掉的体重近2/3是脂肪!
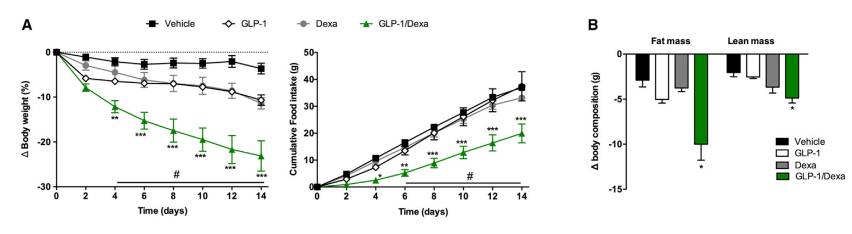
空白对照组、GLP-1和地塞米松单独使用组及GLP-1/Dexa的对比,GLP-1/Dexa组的体重(左)和摄食量(中)明显下降,且减重大部分为脂肪(右)
此外,GLP-1/Dexa可减少小鼠的摄食量,对降低体重起到了辅助作用,这与单独使用糖皮质激素导致的摄食增加截然相反[8]。GLP-1/Dexa的联合使用还避免了糖皮质激素促进肝葡萄糖输出引发的血糖上升,GLP-1也发挥了本身促胰岛素分泌,改善血糖代谢的作用。但在用于吃普通饲料的低体脂小鼠时,GLP-1/Dexa的作用明显减弱,对基因改变导致的肥胖小鼠结果也类似,因此研究人员认为,GLP-1/Dexa主要针对饮食诱导的肥胖过程起作用。
而在避免糖皮质激素的其他副作用上,GLP-1/Dexa也达到了预期。研究人员对小鼠肾上腺和下丘脑进行的分析显示,GLP-1/Dexa没有影响与下丘脑-垂体-肾上腺轴调节密切相关的多种基因表达水平,因此受到这一通路调节的排尿、昼夜节律等相关生理现象没有显著变化,血液内糖皮质激素的浓度也未受到影响,充分体现了结合用药手段的精确输送能力。同时小鼠的骨密度及相关分子指标正常,骨质疏松这个激素治疗的常见并发症并未出现。
GLP-1/Dexa是通过怎样的机制实现了安全减肥呢?研究人员发现,GLP-1/Dexa不仅会使与GLP-1和地塞米松作用相关的下丘脑内众多基因表达水平发生改变,还会另外单独影响126种基因的表达,其中包括了与下丘脑调节的炎症反应相关的自噬、蛋白质水解等机制,也有与细胞内能量水平变化相关的FOXO1、PPAR等信号通路。此外,GLP-1/Dexa还可激活下丘脑内的POMC神经元,而此前已有大量研究显示POMC神经元可通过抑制食欲在预防肥胖中起到重要作用[9]。因此,GLP-1/Dexa的减肥不止是从控制下丘脑调节的炎症反应这一个角度入手,而是带来了一整套有序的代谢改变。
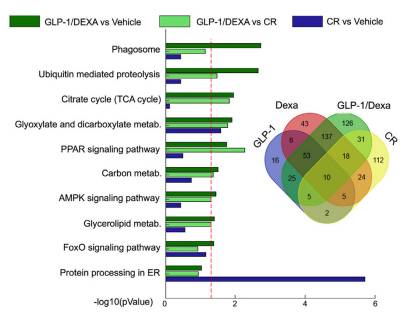
GLP-1/Dexa引发的基因表达改变和信号通路变化
进一步的分析显示,GLP-1/Dexa可减少IL-1β、IL-6、TNF-α等多种炎症介质的表达水平,对饮食诱导的致肥胖炎症反应起到选择性逆转的作用,这就大大拓宽了它的潜在作用价值,因为炎症反应还与胰岛素敏感性、血糖代谢等多种肥胖时出现异常的代谢机制有关。
当然,GLP-1/Dexa也并不是“一呼百应”。研究人员发现,GLP-1/Dexa引发的基因表达水平变化是不能在缺乏GLP-1受体的组织中观察到的。虽然GLP-1受体分布广泛,中枢系统和外周系统的调节也都参与了GLP-1/Dexa导致的代谢改变,但这些改变有着明确的作用范围,从而避免了地塞米松被送到“不受欢迎”的器官和细胞,导致副作用。虽然研究人员的初衷是让GLP-1主要发挥载体功能,进行激素的定向输送,但在实际起效过程中,GLP-1也参与了对中枢神经系统的调节,并未让地塞米松“孤军奋战”。

GLP-1/Dexa的整体作用
虽然效果喜人,不过GLP-1/Dexa仍需要时间才能真正投入使用。本次研究对小鼠的观察期为2周,所以还需进一步试验来确定长期使用激素的影响。炎症反应的抑制也会影响机体对病原体的抵抗力,制备更高纯度的GLP-1/Dexa结合物同样需要解决。此外,试验也显示GLP-1/Dexa对基因层面改变导致的肥胖治疗效果并不明显,因此是否适合大范围使用仍需要临床试验的考量。
但整体而言,GLP-1/Dexa的结合用药体现出了良好的效率和安全性,因此很有潜力成为新的减肥神药。只要别像一位奇点糕开玩笑的说法,“两周减掉25%,那用两个月不就减没了”就好……

参考资料:
1.http://www.cell.com/cell-metabolism/fulltext/S1550-4131(17)30550-8
2.Lumeng C N, Saltiel A R. Inflammatory links between obesity and metabolic disease[J]. The Journal of clinical investigation, 2011, 121(6): 2111.
3.Hotamisligil G S. Inflammation, metaflammation and immunometabolic disorders[J]. Nature, 2017, 542(7640): 177-185.
4.Tschöp M H, Finan B, Clemmensen C, et al. Unimolecular polypharmacy for treatment of diabetes and obesity[J]. Cell metabolism, 2016, 24(1): 51-62.
5.Schäcke H, Döcke W D, Asadullah K. Mechanisms involved in the side effects of glucocorticoids[J]. Pharmacology & therapeutics, 2002, 96(1): 23-43.
6.Finan B, Yang B, Ottaway N, et al. Targeted estrogen delivery reverses the metabolic syndrome[J]. Nature medicine, 2012, 18(12): 1847-1856.
7.Lynch L, Hogan A E, Duquette D, et al. iNKT cells induce FGF21 for thermogenesis and are required for maximal weight loss in GLP1 therapy[J]. Cell metabolism, 2016, 24(3): 510-519.
8.Asensio C, Muzzin P, Rohner-Jeanrenaud F. Role of glucocorticoids in the physiopathology of excessive fat deposition and insulin resistance[J]. International Journal of Obesity, 2004, 28(S4): S45.
9.Thaler J P, Yi C X, Schur E A, et al. Obesity is associated with hypothalamic injury in rodents and humans[J]. The Journal of clinical investigation, 2012, 122(1): 153.
















