
程序性死亡受体-1/ 程序性死亡受体- 配体1信号通路小分子抑制剂的研究进展
刘笑
1,2
,刘欣
2
,纪剑峰
2
,尤启冬
1
*
(1. 中国药科大学药物化学教研室,江苏 南京 210009;2. 南京圣和药业股份有限公司,江苏 南京 210018)
[
摘要]
程序性死亡受体-1(PD-1)是主要表达于 T 细胞表面的共受体,与其配体(PD-L1、PD-L2)结合能够抑制 T细胞的活化。研究发现多数肿瘤细胞能产生 PD-L1 ,并通过激活 PD-1/PD-L1 信号通路抑制效应 T 细胞的活性,阻断该通路可以增强机体内源性抗肿瘤免疫应答。目前在研和(或)已上市的 PD-1/PD-L1 信号通路抑制剂多为单克隆抗体,与之相比小分子抑制剂在成药性和药动学性质等方面有着先天的优势。综述PD-1/PD-L1 信号通路小分子抑制剂的研究进展。
[
关键词]
肿瘤;免疫治疗;程序性死亡受体-1/ 程序性死亡受体-配体1 信号通路;小分子抑制剂
近年来, 抗体类程序性死亡受体
-1
(
PD-1
)
/
程序性死亡受体
-
配体
1
(
PD-L1
)通路抑制剂已经应用于肿瘤的临床治疗,并取得了不错的效果。然而,这类药物在具有良好的临床疗效的同时,往往还伴随着明显的免疫相关不良反应(
immune-relatedadverseevents
,
irAEs
)。较长的半衰期和长达数月的靶点停留时间导致的持续靶点抑制是抗体类药物产生
irAEs
的主要原因。为了解决这一难题,科研人员开始着眼于
PD-1/PD-L1
小分子抑制剂的研发。本文就
PD-1/PD-L1
小分子抑制剂的研究进展进行总结。
1 PD-1
及其配体
PD-1
(
CD279
)是一种抑制性受体,由
288
个氨基酸组成,属于免疫球蛋白
CD28
超家族。其在活化的
T
细胞、
B
细胞、自然杀伤(
NK
)细胞以及抗原提呈细胞等多种免疫细胞表面均有表达,且在肿瘤患者体内活化的
T
细胞表面表达上调。其对应的受体
PD-L1
(
B7-H1
,
CD274
)主要表达于免疫细胞或非造血细胞。
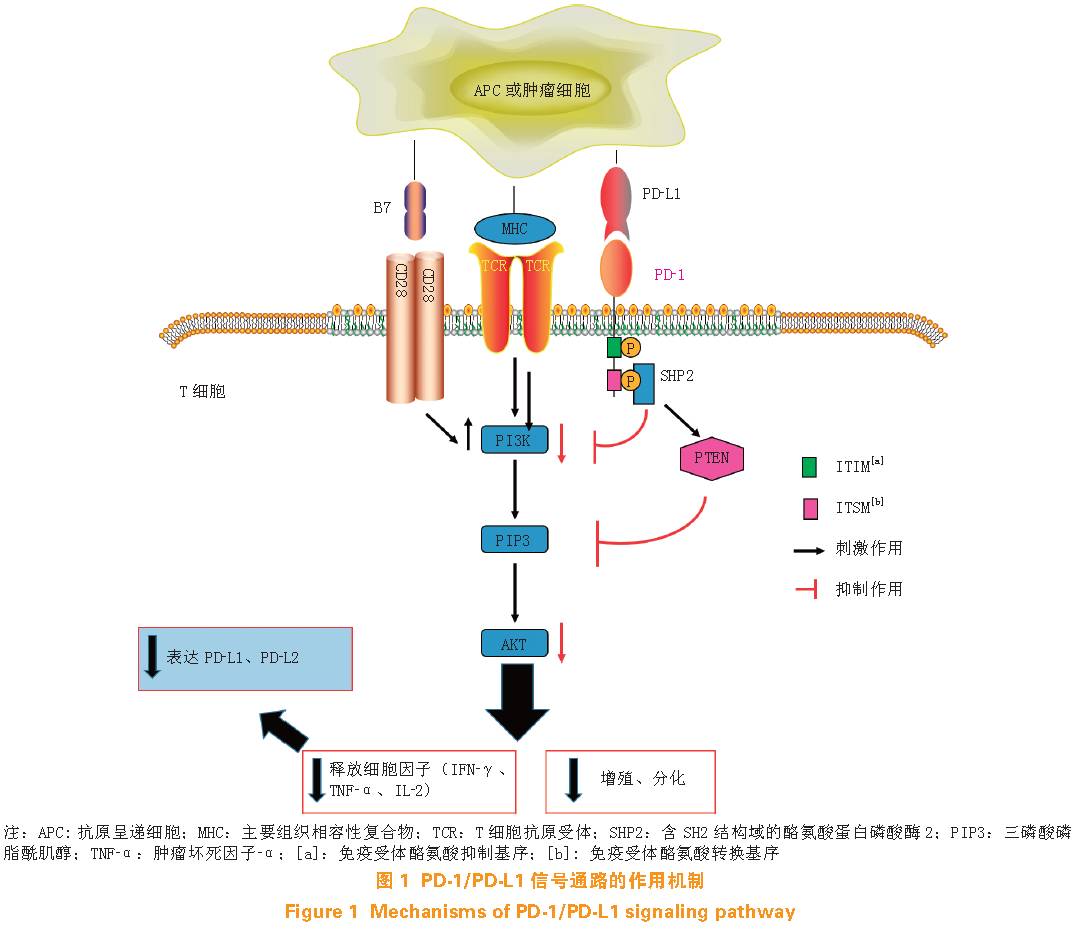
PD-1/PD-L1
信号通路的作用机制如图
1
所示。
T
细胞活化后能触发
PD-1
的表达,同时活化的
T
细胞释放的
γ
干扰素(
interferon-
γ
,
IFN-
γ
)、白细胞介素
-4
(
interleukin-4
,
IL-4
)等细胞因子会使
PD-L1
、
PD-L2
的表达上调,
PD-L1
又能通过与
PD-1
结合抑制
T
细胞的活性并导致其凋亡。这就构成了一个负反馈循环,这一调节机制能防止
T
细胞受到过度刺激,使
T
细胞保持对自身抗原的免疫耐受,并减轻免疫反应对周围组织的损伤。然而
PD-L1
在多种肿瘤细胞(非小细胞肺癌、黑色素瘤、肾细胞癌、前列腺癌、乳腺癌、胶质瘤
等)中也有表达,研究发现磷脂酰肌
醇
3-
激酶(
PI3K
)
-
蛋白激酶
B
(
PKB
,又称
AKT
)、间变性淋巴瘤激酶(
ALK
)、信号传导及转录激活因子(
STAT
)等信号通路能诱发肿瘤细胞表达
PD-L1
,并通过
PD-1/PD-L1
通路抑制
T
细胞的活性。这就是肿瘤细胞实现免疫逃逸的主要机制。因此,阻断
PD-1
与其配体
PD-L1
的结合有助于提高机体的抗肿瘤免疫能力,这也为
PD-1/PD-L1
介导的肿瘤免疫疗法提供了理论基础。
2PD-1/PD-L1
信号通路小分子抑制剂
2.1
肽衍生物类抑制剂
印度的
Aurigene
公司在
PD-1/PD-L1
通路抑制剂领域进行了深入的研究。
Aurigene
公司与
LaboratoiresPierre Fabre
的研究人员曾宣布共同开发化合物
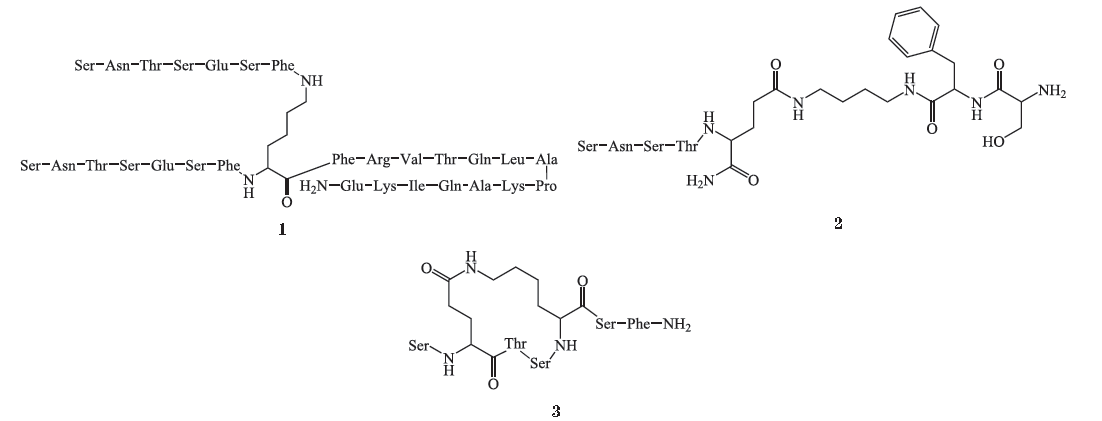
AUNP-12
。该化合物是首个多肽类
PD-1/PD-L1
信号通路抑制剂,其特殊意义在于突破了
PD-1/PD-L1
抗体药物在药动学上的局限性,具有更短的半衰期,能显著降低
irAEs
的发生率。研究人员在设计该化合物时,充分考虑了
PD-1
胞外结构域在与配体结合时发挥的重要作用,并以此为切入点,通过模拟人和小鼠
PD-1
胞外结构域的氨基酸序列设计出一系列
7 ~ 30
个氨基酸的肽衍生物。
AUNP-12
作为其中活性最好的化合物,在动物试验中表现出优良的抗
PD-L1
活性,能够有效抑制肿瘤细胞的生长和转移。另外,值得注意的是,
AUNP-12
还具有良好的耐受性,在所有测试剂量中均未表现出明显的毒性。目前
Aurigene
公司并未公布
AUNP-12
的具体结构,但根据其申请的专利中相关化合物的生物数据,可以推测出
AUNP-12
的可能结构(化合物
1
)。
除
AUNP-12
外,
Aurigene
公司的科研人员还通过
小鼠脾细胞增殖试验、人外周血单核细胞(
peripheralblood mononuclear cell, PBMC
)增殖试验等生物测试方法筛选出多种其他类型的肽类
PD-1/PD-L1
信号通路抑制剂。
其中一个系列为
7 ~ 8
个氨基酸的直链肽衍生物,以化合物
2
的活性最优,其在
B16F10
黑色素瘤肺转移模型小鼠的体内活性试验中,使肿瘤转移发生率下降
64%
(
sc
,
qd
,
5 mg
· kg
-1
,
14 d
)。
另一个系列为
7 ~ 9
个氨基酸的环状肽衍生物,其特点是将氨基酸残基的
N
末端和
C
末端通过酰胺键相连形成固定的环状结构。这类化合物的抗
PD-L1
活性已在小鼠脾细胞增殖试验中得到验证。其中具有代表
34 5
性的是化合物
3
,其在
B16F10
黑色素瘤肺转移模型小鼠的体内活性试验中,使肿瘤转移发生率下降
54%
。
Aurigene
公司对环肽类
PD-1
信号通路抑制剂进行了更深入的研究,并在专利中公开了两类新的肽衍生物结构(环状肽衍生物和开链肽衍生物,化合物
4
、
5
)。科研人员设计了一项小鼠脾细胞增殖试验来验证这些化合物的活性:通过在重组配体(
PD-L1
、
PD-L2
)存在下向抗
CD3/CD28
刺激的脾细胞中加入需要浓度(
100 nmol
· L
-1
)的目标化合物来测试化合物效应,结果,化合物
4
、
5
使脾细胞增殖率分别达
82%
和
81%
,表明专利化合物对
PD-L1
和
PD-L2
均有显著的抑制作用。
Aurigene
公司的研发人员在同期研究中还发现由二酰基肼和脲连接的三肽衍生物也能够抑制
PD-L1
和
PD-L2
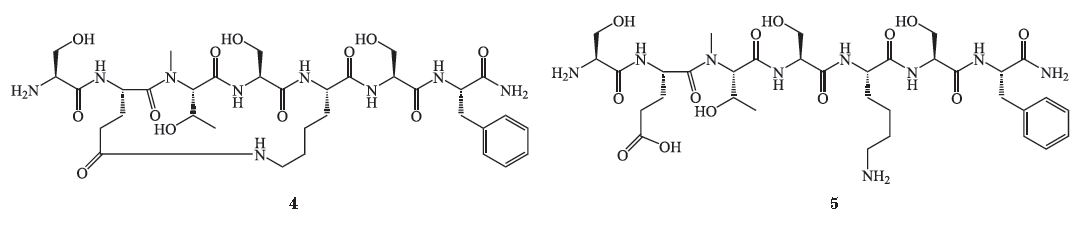
的活性。据专利报道,这类化合物的
IC
50
为纳摩尔级。以化合物
6
为例,其对
PD-L1
、
PD-L2
的
IC
50
分别为
30
和
40 nmol
· L
- 1
。此外,在
CT-26
结肠癌小鼠模型中进行的体内药效试验显示,化合物
6
的抑瘤率为
46%
(
3 mg
· kg
-1
,
25 d
)。这一试验结果促使
Aurigene
公司对这类结构进行了进一步研究,并设计了一系列同样以二酰基肼和脲为连接基团、囊括更多种氨基酸残基的三肽衍生物(化合物
7
、
8
)。
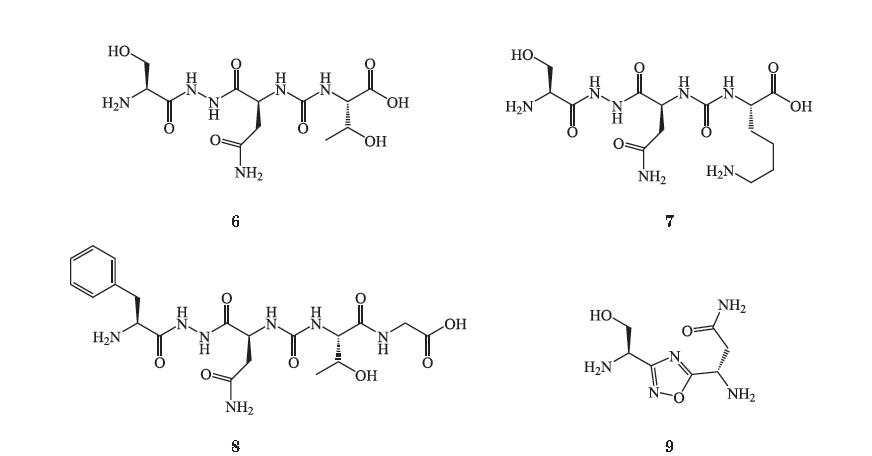
在上述含有二酰基肼和脲结构的化合物的基础上,
Aurigene
公司的研发人员又设计合成了一系列以二唑、噻二唑为核心结构,同时含有二酰基肼和(或)脲结构的三肽衍生物(化合物
9
~
12
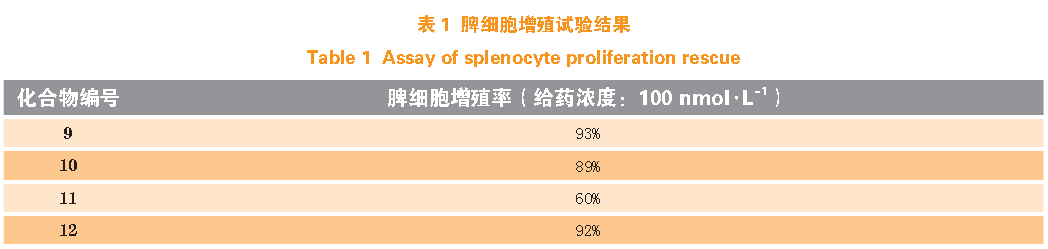
),在一项脾细胞增殖试验中,研究人员通过在重组配体
PD-L1
存在下向抗
CD3/CD28
刺激的脾细胞中加入需要浓度(
100 nmol
·L
-1
)的目标化合物来测试化合物的抗
PD-L1
活性,结果显示这些化合物最高可使脾细胞增殖率达
93%
(见表
1
)。
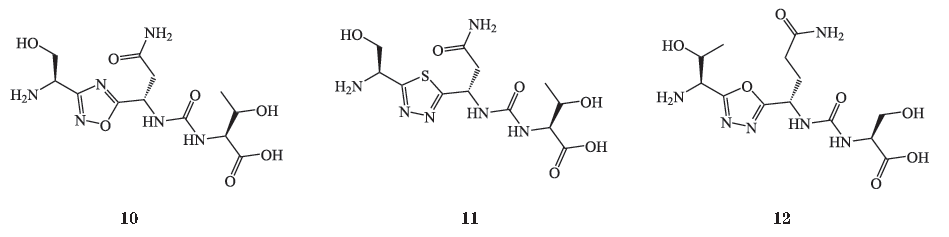
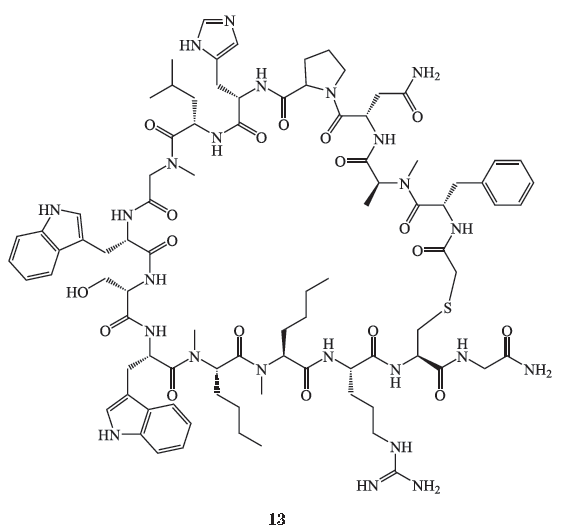
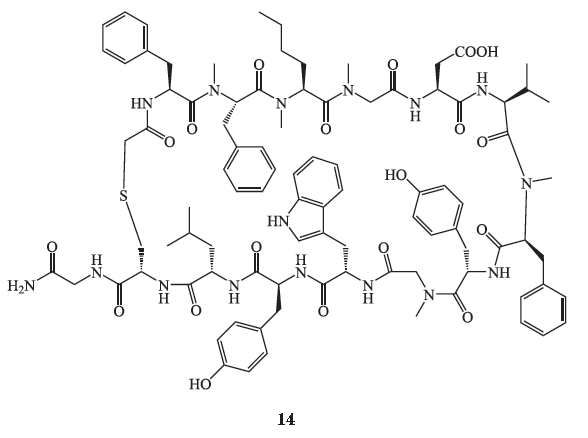
此外,百时美施贵宝(
BMS
)公司在
PD-1
抗体药物
Opdivo
成功上市后,也对
PD-1/PD-L1
信号通路小分子抑制剂领域进行了探索。其研发团队近年来公布了一类可免疫调节
PD-1/PD-L1
信号通路的大环多肽类抑制剂(化合物
13
、
14
),其
IC
50
如表
2
所示。

国内对
PD-1/PD-L1
信号通路小分子抑制剂的研究也取得了一定的成果。清华大学的刘磊教授及其课题组通过镜像噬菌体展示技术发现了一组能够特异性拮抗
PD-L1
的
D
型多肽免疫检查点抑制剂。表
3
列举了这一系列化合物的氨基酸序列和
K
D
。其中活性最好的化合物为
D
PPA-1
,在体外
PD-L1
结合试验中,
D
PPA-1
的亲和浓度为
0.51
μmol · L
-1
;
CT26
小鼠的体内活性试验同样证明
D
PPA-1
具有抗















