
►12月10日,2016年诺贝尔生理学或医学奖得主、日本东京工业大学名誉教授大隅良典(Yoshinori Ohsumi)领取证书、奖牌
编者按:
12月10日(斯德哥尔摩当地时间),诺贝尔科学奖颁奖仪式在瑞典斯德哥尔摩市音乐厅举行,日本分子细胞生物学家大隅良典独享2016年诺贝尔生理学或医学奖这一大奖。实际上,这在诺贝尔科学奖越发越多、越发越晚的大科学时代是不多见的。
大隅良典何以能够独享今年的诺贝尔生理学或医学奖?他所做的开创性科学贡献究竟有何应用前景?他是如何成长为一名杰出的科学家的?北京大学哲学系暨科学与社会研究中心教授周程从科学传播视角主要基于一手文献对这些问题进行了考察,并给出了尝试性的回答。
撰文 | 周程(北京大学哲学系暨科学与社会研究中心教授)
责编 | 程莉
● ● ●
为了将吸入肺泡的氧气输送给各个组织,同时将组织中新陈代谢产生的二氧化碳运送到肺部并排出体外,人体每秒大约需要产生300万个红血球。这意味着,人体每秒至少得合成出1000万亿个血红蛋白。从外表上看,我们每天并没有发生明显的变化,但实际上我们体内的蛋白质几乎每过2至3个月就会更换一次 。
我们每天通过饮食摄取的蛋白质数量有限,而且摄取的蛋白质需要先降解为氨基酸等小分子物质,然后再合成为所需蛋白质。研究表明,成人人体每天需要合成250克以上蛋白质。如果仅仅依靠饮食补充的氨基酸,根本无法合成出这么多的蛋白质。实际上,我们每天通过饮食补充的氨基酸,只能合成出70克左右蛋白质。其余的蛋白质主要通过降解体内老化蛋白质以及受损线粒体等细胞器获得 。
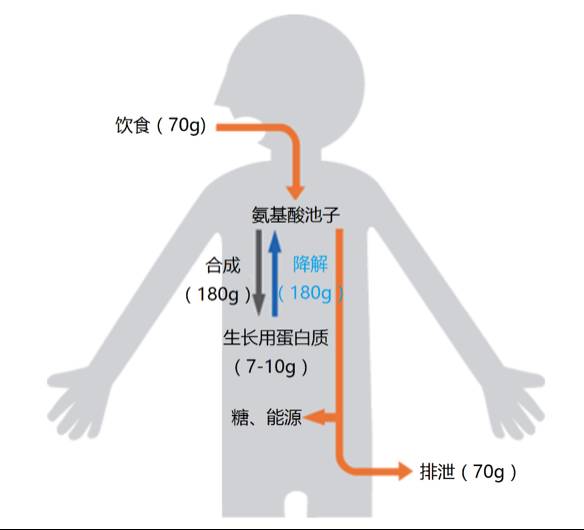
►成人每天的蛋白质代谢情况
现已究明,真核细胞内主要存在两条降解途径。
一条是泛素调节的蛋白降解途径。在这条途径中,由76个氨基酸组成的高度保守的多肽链小蛋白泛素担负着主要的角色。它先识别不要的蛋白质,并与之结合,然后由蛋白酶体来进行降解。这条选择性降解途径是由以色列科学家阿龙·切哈诺沃(Aaron Ciechanover,1947-)、阿夫拉姆·赫什科(Avram Hershko,1937-)和美国科学家欧文·罗斯(Irwin Rose,1926-2015)率先发现的,他们因此而获得2004年的诺贝尔化学奖 。
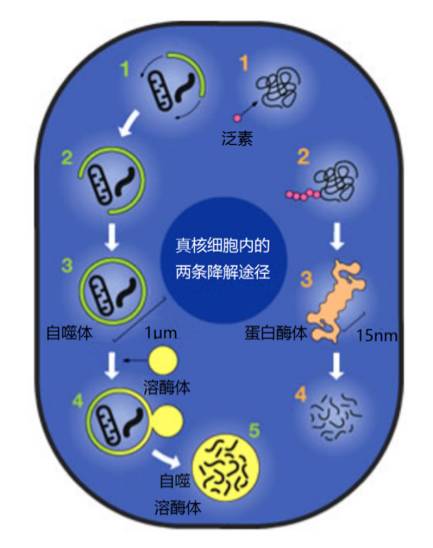
►真核细胞内的两条降解途径
另一条是细胞自噬途径,它是一条非选择性降解途径。细胞自噬的具体过程为:细胞内出现隔离膜;隔离膜在相关蛋白的作用下不断扩展,并将周围的老化蛋白质、线粒体等细胞器围在其中;隔离膜生长成双层膜结构的自噬体;自噬体与内部含有多种水解酶的溶酶体接触后,其外膜与溶酶体融合;自噬体内膜与内含物被水解酶降解为氨基酸等小分子物质,形成自噬溶酶体;氨基酸等小分子物质进入细胞质,为蛋白质合成提供氨基酸补充 。
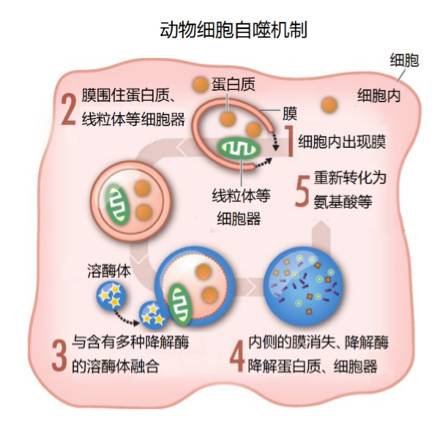
►动物细胞自噬机制示意图
自噬概念是由洛克菲勒大学教授德迪夫(Christian de Duve,1917-2013)率先提出的。他在上个世纪50年代借助光学显微镜和电子显微镜观察到了动物细胞中的溶酶体,并在1963年溶酶体国际会议上首先提出“自噬”这一说法。1974年,德迪夫因发现“细胞的结构与功能组织”而与另外二人共同获颁诺贝尔生理学或医学奖 。
德迪夫虽然很早就用电子显微镜观察到了自噬现象,但直至上个世纪80年代末,学界对自噬具有什么样的生理学意义、它与哪些分子群有关、与之有关的基因有哪些等问题都没有给出任何有说服力的解释。因此,当日本学者大隅良典(OHSUMI Yoshinori,1945-)在上个世纪90年代使用芽殖酵母成功地揭开自噬现象背后的奥秘之后,学界给予了高度的评价。
细胞自噬分子机理的发现,为人类理解和治疗很多疾病提供了可能。譬如,人们发现,神经细胞不能自噬后,细胞内的老化蛋白质大都不能被循环利用,这些老化蛋白质越积越多之后,很容易诱发神经功能障碍,以致出现老年痴呆症状。人们还发现,自噬不仅可以帮助细胞度过饥饿期,而且它还可以降解侵入细胞中的细菌等病原体以及其他有害蛋白质,从而增强人体的“免疫力”。还有,人体衰老与细胞自噬功能弱化、体内老化蛋白质和受损细胞器不能得到及时清除似也有着一定的关联 。此外,人们还有可能利用细胞的自噬机制,主动让癌细胞丧失自噬功能,迫使癌细胞无法获取足量氨基酸以合成所需蛋白质,从而将癌细胞“饿死”。
由于细胞自噬分子机理的发现,增进了人类对细胞亚结构的理解,开辟了广阔的医学应用前景,因此瑞典皇家科学院诺贝尔奖委员会将2016年的诺贝尔生理学或医学奖授予大隅良典,而且只授给他一个人。这在诺贝尔科学奖越发越多、越发越晚的大科学时代,实属少见 。实际上,尽管自2000年以来的17年里日本已有17人荣获诺贝尔科学奖(含2名日裔美籍学者),但单独获奖,这在新世纪的日本还是第一次。
大隅良典究竟是一个什么样的奇人?他是怎样发现酵母细胞自噬过程的?他何以能够揭示细胞自噬的分子机制?以下,拟围绕这样问题做些粗浅的考察。
大隅良典1945年2月9日出生于日本九州的福冈市。其父大隅芳雄已故,生前曾任九州大学工学院矿山学教授。外祖父长沼贤海也是九州大学教授,不过主攻的是日本史。大隅良典在家中排行最小,有一个哥哥和两个姐姐。长兄大隅和雄比他大12岁,退休前任东京女子大学日本文化史教授。因此,可以说大隅良典出身于书香门第。

►大隅良典少年时代和父母的合影
1960年,大隅良典考入县立福冈高级中学。该校拔尖学生毕业前夕大多会就近报考旧制帝国大学之一的九州大学。郭沫若早年就毕业于这所大学。不过,大隅良典高中毕业时却报考了远在千里之外的东京大学。当时,福冈与东京之间尚未开通新干线,去东京十分不便。

►福冈中学时代的大隅良典(正中间)
1963年,大隅良典进入东京大学教养学部(相当于美国的文理学院)理科二类学习。之所以选择理科,主要有三个原因:
一是由于战后初期物资匮乏,母亲患上了肺结核,长期卧床不起,后来使用从美国进口的链霉素等药物,奇迹般地得到了康复。这使他从小就对科学产生了好感。
二是就读于东京大学的哥哥每次回老家都会给他带一些科普读物,例如法拉第的《蜡烛的化学史》、八杉龙一的《生物的历史》、三宅泰雄的《空气的发现》等。这些书籍使他对科学产生了浓厚的兴趣。
三是从事工科教育的父亲不希望两个儿子都学文科,在哥哥已经选择了日本史的情况下,他只有报考理科才不至于令父亲大失所望。
东京大学创立于1877年,是日本最古老的大学。二战结束之后,在美国教育使节团的主导下,东京大学实行了一系列改革。譬如,将文科和理科各划分成三类,按大类招生,实行宽口径培养;成立教养学部,统管一、二年级本科生的教学;让学生完成两年的学业之后再选择专业,进入自己喜爱的研究室学习。如果选择某一专业的人比较多,则按绩点高低划线。这种不急于分专业,以及头两年学习成绩好的学生优先选择研究室的做法对调动学生的学习积极性功效甚大。

►东京大学时代的大隅良典
1965年,大隅良典在教养学部完成前期课程的学习后,原本想进理学部学习化学,因教养学部为三、四年级学生新设了跨学科类的基础科学系,故其最终决定留在教养学部后期课程继续深造。正是在教养学部,他有幸结识了著名的分子生物学专家今堀和友(IMAHORI Kazutomo,1920-2016)教授。在分子生物学研究刚刚兴起,遗传密码刚开始被接二连三破译的上个世纪60年代,就能接触到分子生物学研究大家,对大隅良典来讲,不能不说是一种幸运。

►大隅良典(左二)本科毕业时和今堀和友教授(正中)的合影
1967年从教养学部本科毕业后,大隅良典考入东京大学研究生院理学系研究科(独立于理学部),在前田章夫(MAEDA Akio,1933-)副教授的指导下使用大肠菌开展蛋白质合成研究。1969年硕士毕业后,大隅良典决定继续留在理学研究科攻读博士学位。在此期间,他与实验室中的一名比他低两年级的女硕士生相恋,并在博士二年级时与之结婚,不久后就有了孩子。这对大隅良典的博士论文写作无疑产生了不小的影响。此外,导师前田章夫中途由东京大学调至京都大学似乎也对其博士论文的写作产生了一些影响。

►博一时大隅良典和同学们在一起(1年后与右侧的女生结婚)
1972年,大隅良典在理学研究科修满博士课程所需学分后满期退学,因找不到合适的工作,于是转入东京大学农学部农艺化学专业,在已经就业的夫人大隅万里子的全力支持下,以研修生的身份跟随1968年转任农学部教授的今堀和友学习,并于1974年以题为“关于大肠菌素E3的作用机制研究”的论文在农学部申请获得理学博士学位。
东京大学的硕士课程最低学习年限为两年,博士课程最低学习年限为三年。一般来讲,在那个年代,理科博士生用三年攻下博士学位的不低于八成,文科博士生用三年攻下博士学位的不高于两成。大隅良典在理科院系攻读三年拿不到博士学位无疑属于少数派。
大隅良典的导师今堀和友教授曾师从著名的结构化学专家、现皇后美智子的侄子水岛三一郎(MIZUSHIMA Sanichirō,1899-1983)教授。因在蛋白质结构等生物化学研究领域颇有建树,水岛教授曾于1962年、1964年两度获得诺贝尔化学奖提名。由此看来,说大隅良典出身学界名门并不为过。
1974年底,在今堀和友教授的引荐下,大隅良典远赴美国洛克菲勒大学埃德尔曼(Gerald Maurice Edelman,1929-2014)教授研究室,开始从事博士后研究。埃德尔曼因发现抗体化学结构而与其合作者波特(Rodney Robert Porter,1917-1985)一起共享了1972年的诺贝尔生理学或医学奖 。虽然早期一直在从事抗体结构的解析研究,但摘得诺贝尔奖桂冠之后,试图再次折桂的埃德尔曼开始由免疫学研究转向发育生物学研究。大隅良典正是在这一时期来到埃德尔曼研究室的。
巧合的是,率先提出自噬概念的洛克菲勒大学教授德迪夫也是在1974年12月获颁诺贝尔生理学或医学奖的。大隅良典当时恐怕做梦都没有想到,他后来竟会和自噬研究结下不解之缘。

►大隅良典在洛克菲勒大学时期与夫人和孩子的合影
大隅良典在埃德尔曼教授研究室最初从事的是小鼠体外受精研究,但因该项研究与先前的研究跨度过大,以致忙碌一年半后仍未取得太大的进展。于是,埃德尔曼教授让他以细胞增殖调控为题,使用芽殖酵母,开展DNA复制研究。酵母是直径只有5微米的单细胞真核微生物,人们制作面包、酿造啤酒时都要用到它。由于酵母结构简单,因此常被用作开展高等真核生物研究的模式生物。正是在美国与酵母结缘,大隅良典后来才得以将德迪夫提出的自噬概念化作具体的科学事实。
►酵母镜像
在使用酵母开展DNA复制研究过程中,大隅良典同样收获不大,但他在使用离心分离机分离酵母细胞核过程中发现,离心管的顶部有不少浓缩了的细胞器。大隅良典进一步研究后确认,原本打算扔掉的那些细胞器是酵母的液泡。当时,学界对酵母细胞中的液泡认识有限,以为液泡在细胞中只担负着“垃圾池”的角色。但大隅良典推测,液泡在酵母细胞中很有可能发挥着某种不为人知的重要功能。
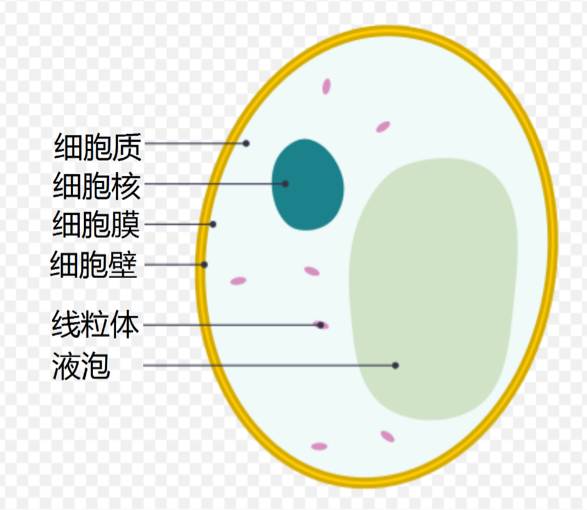
►酵母细胞结构示意图
1976年,安乐泰宏(ANRAKU Yasuhiro,1936-2016)由东京大学药学部转至东京大学理学部担任新成立的植物学专业生物体调控研究室教授 。应安乐泰宏教授的邀请,大隅良典于1977年底返回母校担任植物学专业生物体调控研究室助教,9年之后的1986年晋升为讲师。
当时,安乐泰宏实验室主要从事的是大肠菌的物质输送机制研究。由于在洛克菲勒大学从事博士后研究期间已经熟练地掌握了酵母液泡的分离方法,因此他决定以酵母液泡膜的物质输送机构为题展开研究,以解明物质是如何通过酵母的液泡膜向外或向内渗透移动的。
今天,光学显微镜的放大倍率可达2250倍,但当时的光学显微镜的最大放大倍率只有600倍。使用这种光学显微镜只能看到酵母细胞中的液泡,其他细胞器根本观察不到。因此,很少有人会冒着劳而无功的风险去对酵母的液泡膜展开研究。由于大隅良典不愿意与他人竞赛,喜欢做别人没有做过的研究,因此尽管在安乐泰宏实验室开展酵母液泡膜的物质输送机构研究过程中遇到了不少难题,但他还是顽强地坚持下来了。
在最初几年里,大隅良典不断地重复着培养几十升酵母、开始分离液泡、对纯化后的微量液泡膜展开分析、再培养几十升酵母的研究循环。幸运的是,辛勤的努力最终得到了回报,他发现,约占酵母细胞体积30%的液泡并非只是一个“垃圾池”,它实际上在不断地向外输送氨基酸、离子等物质,从而使酵母细胞质得以维持稳定态。1981年,大隅良典和安乐泰宏教授在《生物化学杂志》(J. Biol. Chem.)上联合发表了此项研究成果 。这项研究被认为开启了液泡膜ATP水解酶研究的先河 。而且,在这项研究过程中确立的大量纯化液泡膜小泡的方法为其后来深入开展液泡膜及液泡研究奠定了重要的基础。
1982年,已在酵母液泡膜研究领域崭露头角的大隅良典以“酵母液泡的生理/生化研究”为题申请日本学术振兴会的一般研究资助项目获得成功,虽然研究资助只有区区的200万日元(不到15万元人民币),但对一个37岁的助教来说,这无异于雪中送炭。结束上述项目研究之后,大隅良典又于1984年以“酵母液泡膜结合性H^+-ATPase与液泡膜输送系统的解析”为题向日本学术振兴会申请获得180万日元的资助。1986年,他又协助安乐泰宏教授在日本学术振兴会的资助下启动了一项与酵母液泡膜的异向共役输送蛋白有关的课题研究(170万日元) 。作为1986年才晋升为讲师、没有自己的实验室的年轻学者,这一时期从事的主要还是与酵母液泡膜的物质输送机构有关的研究。
1988年,大隅良典转任东京大学教养学部副教授,开始拥有自己的实验室。是时,他已年满43周岁。在理学部从事酵母液泡膜研究时,他深切地体会到,虽然追随热点做大家都在做的研究是科学界的一种常态,但是,与其这样,还不如做别人没有做过的研究更有趣,因为“科研的本质是做人家没有做过的事!”
由于安乐泰宏教授对酵母液泡膜的研究已渐入佳境,大隅良典觉得自己到教养学部之后有必要另辟蹊径。于是他放弃了酵母液泡膜研究,开始将探究酵母液泡内的物质降解机理作为自己的研究重点,因为那时人们对物质在液泡内是怎样被降解的以及究竟是什么物质在液泡内被降解了一无所知。
大隅良典的想法获得了日本学术振兴会的支持。该会在1988年同时批给大隅良典两个重点领域研究项目,一个是关于酵母细胞复制调控机构的;另一个是关于酵母性外激素、α因子与钙离子动员机构的。前者资助金额为250万日元,后者的资助金额为170万日元,但一年后又追加了170万日元。虽然这两个项目的资助金额加上一起还不到50万元人民币,但已过不惑之年的大隅良典在升任教养学部副教授的最初两年,使用这两笔来之不易的经费以及名下的稳定支撑经费打造出了一个足以开展酵母液泡研究的新实验室。
►细胞中的液泡
当时,大隅良典推测,液泡很有可能在酵母细胞中发挥着与动物细胞中的溶酶体一样的功能。为了弄清酵母液泡内究竟发生了什么,大隅良典用光学显微镜对酵母液泡进行了长时间的观察,但是收获甚微。一天,他突然意识到,酵母陷入饥饿状态后,会改变细胞内部组分,形成孢子,进入休眠状态,以度过饥饿期。如果液泡真的具有降解功能,那降解应该是在形成孢子的饥饿期反应得最为激烈。否则,孢子在形成过程中就无法获得所需物质成分。倘若能在细胞处于饥饿期时抑制住液泡内的降解反应,就可以摸清即将被降解的究竟是什么物质。

►酵母细胞在饥饿状态下分裂成4个孢子
于是,大隅良典从美国的酵母保藏中心订制了一批液泡内不含降解酶的酵母突变体,并将这些酵母突变体置入缺乏氮源的培养基上,然后借助显微镜观察液泡内的氮源饥饿反应。令他感到惊讶的是,酵母突变体饿了一段时间后,其液泡中会出现小颗粒,而且随着时间的推移,这些小颗粒会越积越多。同时,这些小颗粒在液泡中会不停地进行无规则的布朗运动。这意味着液泡中的物质黏性很低,几乎没有蛋白质。
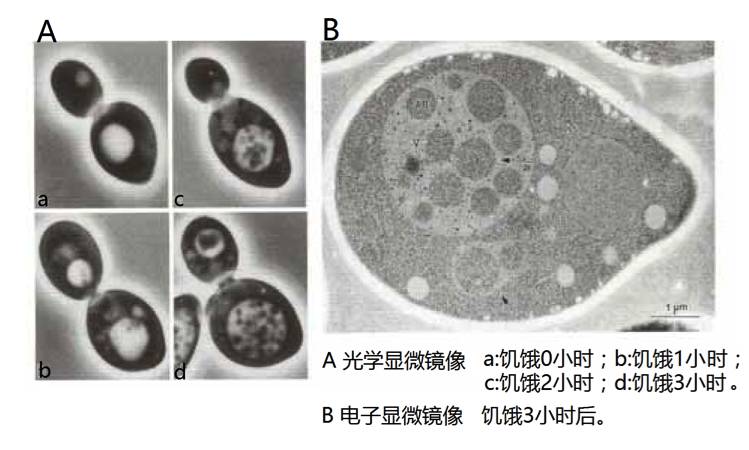
►处于饥饿状态的酵母细胞内的状况(白色的大圆是液泡)
问题是这些小颗粒是如何出现在液泡内的?为了弄清液泡内小颗粒的形成机理,大隅良典又对液泡及其周边进行了长时间的观察,结果发现:当酵母突变体处于饥饿状态时,其细胞中会出现双层膜结构;这种膜结构会自动卷曲成一个具有开口的小球,随后开口逐渐闭合;小球(后被命名为“autophagosome”,即自噬体)与液泡接触后,其外膜与液泡膜开始融合,并把融掉外膜后形成的小球体(后被命名为“autophagic body”,即自噬小体)输入液泡内;输入液泡内的小球体在降解酶稀薄的液泡内开始随机地做无序运动。
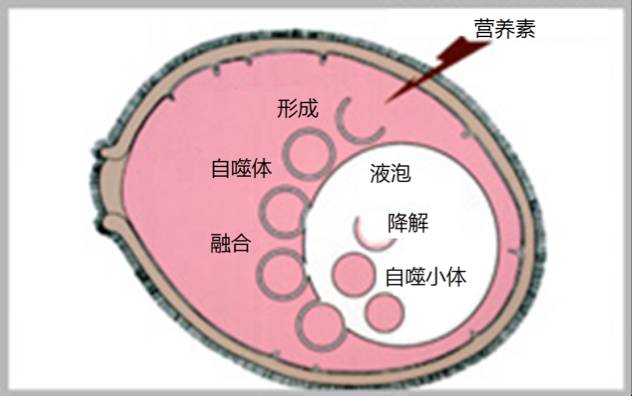
►自噬体在酵母细胞中的形成与发展过程
使用正常的酵母,对自噬体所包裹的物质成分以及自噬小体在液泡中的降解过程等问题展开深入研究之后,最终,大隅良典团队和电子显微镜操作能手、东京女子大学理学部研究员马场美铃(BABA Misuzu,现62岁)合作,清晰地揭示出了酵母细胞的自噬过程:
a.细胞中出现双层膜结构;
b.这种膜弯曲成一个具有开口的小球,将附近的一些蛋白质、线粒体等细胞器“吞”进小球内;
c.小球的开口完全闭合,成为自噬体;
d.自噬体外膜与液泡膜接触融合;
e.单层膜结构的自噬小体进入液泡内;
f.自噬小体中的物质在降解酶的作用下迅速降解成氨基酸等新物质。
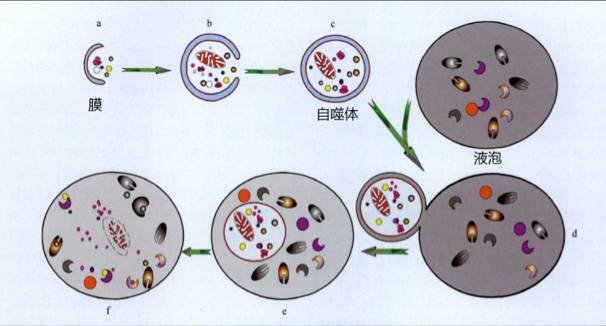
►酵母细胞的自噬过程
虽然酵母细胞的自噬过程早在1990年就已解明,但该项研究成果拖至1992年才得以公开发表。最初,大隅良典想把该项研究成果拆成两篇文章发表,一篇着重进行形态学描述,另一篇着重介绍生理学过程。但是,编辑部表示,只有将两篇文章合成一篇,他们才会刊发。这样来来回回地折腾了两年,至1992年10月,该项研究成果才得以在洛克菲勒大学编辑发行的《细胞生物学杂志》(Journal of Cell Biology)上公开发表 。
发现自噬是确保酵母在饥饿状态下仍能长时间存活的关键因素之后,接下来的问题便是如何对酵母进行遗传筛选,确定与自噬有关的遗传基因?
大隅良典最初想到的是,先对酵母的遗传基因进行随机突变处理,然后通过显微镜观察,看看哪个基因发生突变后,酵母突变体即使处于饥饿状态也不会出现自噬?于是,他开始分批制作基因发生了突变的酵母,并把它一个一个地移到无氮源培养基上,然后通过显微镜观察其液泡内是否出现了自噬小体。如此观察了一千多个酵母突变体,才发现了一个不能自噬的细胞。分离出这个基因之后,他将其命名为APG1(Autophagy-relaetd Genes),后又尊重其他学者的提议将其称作为ATG1。
大隅良典在实验过程中发现,基因ATG1发生突变后,不仅酵母突变体的液泡内不会出现自噬小体,而且该突变体在饥饿状态下只能存活两天。他意识到,可以利用酵母突变体在饥饿状态下很快就死亡这一表征来筛选其他与自噬有关的基因。这比用显微镜逐个观察酵母突变体内是否会出现自噬要简单得多。使用新方法,大隅良典很快就筛选出了近100个在饥饿状态下很快就死亡的突变体。由于细胞不能自噬并非是导致酵母突变体很快死亡的唯一原因,所以还需对这近100个突变体进行更加深入的研究。
经过一年多的努力,大隅良典和开门弟子塚田美树(TSUKADA Miki)一起终于又确定了与自噬有关的14个关键基因。1993年8月,师徒二人将上述重要发现整理成文,并将其投给了《欧洲生化学会联盟通讯》(FEBS Letters)杂志 。两个月后,该杂志便将其公之于世。虽然FEBS Letters 2016年的影响因子只有3.519,但正是这篇论文确立了大隅良典的细胞自噬分子机制研究之父的地位。

►电子显微镜影像前的大隅良典
确定了15个与酵母细胞自噬有关的基因之后,还需要进一步探明根据这些基因提供的遗传信息转录、翻译而成的蛋白质是如果参与自噬的?最初,大隅良典以为,一一确定这15个基因所表达的蛋白质类型会非常耗时,因此动员在私立大学执教、并拥有自己的实验室的夫人大隅万里子出面相助,参与合作研究。
由于酵母的全基因组序列已被基本究明,大隅良典团队在确定各个基因所表达的蛋白质类型过程中并没有遇到太大的困难,所以此项工作很快就结束了。但是,只探明了蛋白质的氨基酸序列还不行,还要弄清这些蛋白质是如何参与自噬的。由于14个与自噬有关的基因都是新型基因,因此仅由其对应的蛋白质类型与结构很难推测出该蛋白质在自噬过程中所发挥的功能。这就像我们很难判断复方中草药中的某种物质在治疗疾病过程中究竟发挥了什么作用一样。
虽然在东京大学教养学部担任副教授期间,大隅良典已经启动了与酵母细胞自噬有关的一些基因的功能研究,但这项引领全球的前沿研究进展并不顺利。在年过半百仍不能晋升教授的情况下,大隅良典于1996年决定辞去东京大学教养学部副教授的职位,转赴爱知县的冈崎国立共同研究机构(现自然科学研究机构)基础生物学研究所担任教授。是时他已年满51周岁。
基础生物学研究所是日本国立研究所,研究条件相当优越。大隅良典抵达冈崎、升任教授后,不仅获得了充裕的研究经费支撑,而且还可以提名聘用多名团队成员。到任第一年,他便聘请擅长动物细胞研究的吉森保(YOSHIMORI Tamotsu,1959-、现任大阪大学教授)担任其实验室的副教授,随后又聘请野田健司(NODA Takeshi,现任大阪大学副教授)和镰田芳彰(KAMADA Yoshiaki)担任研究助手。第二年,他又将东京医科齿科大学的内科医生水岛昇(Noboru Mizushima,1966-、现任东京大学教授)录取为博士后,2002年又将其聘为研究助手。除此之外,大隅良典还从各地录用了一批博士后和研究生。

►基础生物学研究所时期的大隅良典(后排右三)
不过,大隅良典率领团队对酵母的ATG基因的功能大举展开研究之初,并没有取得显著的进展。直至水岛昇1997年加入团队之后,研究才开始出现转机。水岛昇使用大隅万里子实验室克隆出的ATG12做细胞内表达解析实验时发现,ATG12会像泛素一样采用两阶段反应方式和ATG5结合,因此确定它是一种类泛素化修饰蛋白质。英国的《自然》(Nature)杂志于1998年9月刊发了这项重要的研究发现 。之后,大隅良典团队确认,14个ATG基因中至少有5个通过结合反应参与了自噬体膜的建构。这些重要成果于2000年发表在Nature杂志上 。
在探究酵母的ATG基因的功能的同时,水岛昇还和吉森保一起对哺乳类动物的ATG基因进行了解析,之后又对鼠耳芥的ATG基因进行了解析。吉森保和水岛昇等人的研究表明,高等动物和高等植物体内存在和酵母ATG基因几近一样的自噬基因,因此也会出现细胞自噬。不同的是,在酵母和植物的细胞中,蛋白质水解酶包裹在液泡内;在高等动物的细胞中,蛋白质水解酶包裹在溶酶体内。
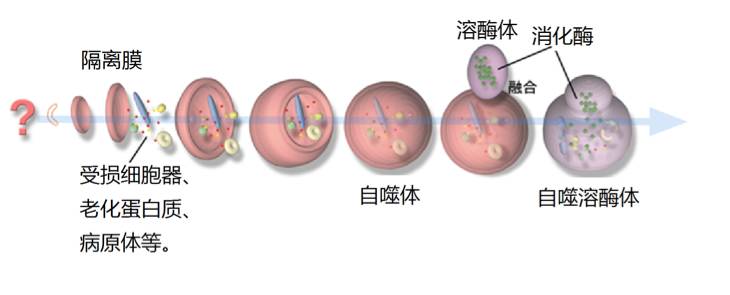
►自噬体在哺乳类动物细胞中的形成模式
2004年,水岛昇使用刚刚兴起的绿色荧光蛋白(GFP)标记技术制成了细胞内的ATG蛋白质可以发光的特殊小鼠。这样便可以使用刚刚问世的荧光显微镜通过观察切片来了解自噬体在细胞内的变化情况。水岛昇发现,刚刚诞生的小鼠,在还没有给其哺乳之前,是靠自噬生存的;而且受精卵在发生初期也离不开自噬。
大隅良典团队将上述研究成果公开后,迅速在学界掀起了一场细胞自噬研究热。此后,各国发表的与细胞自噬有关的论文数量开始急速攀升。大隅良典和水岛昇也因论文总被引次数等数据位居世界前列而于2013年被汤森路透授予“引文桂冠奖” 。
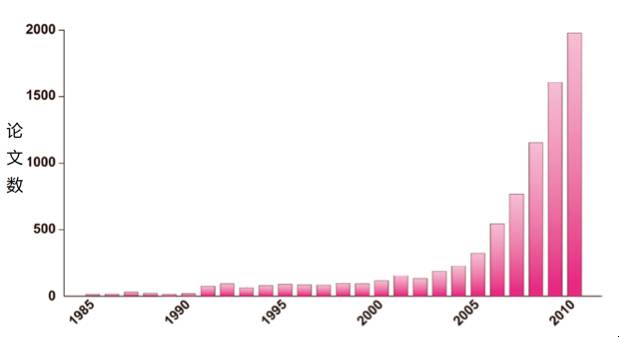
►自噬领域的国际论文发表情况
2004年,在即将届满60岁之际,大隅良典开始兼任日本综合研究大学院大学生命科学研究科教授。2009年,在即将届满65岁之际,他开始转任东京工业大学特聘教授。2014年,年近70岁的大隅良典完全退休,被东京工业大学授予荣誉教授称号。

►在东京工业大学实验室中的大隅良典
在冈崎的基础生物学研究所工作的13年里和在东京工业大学工作的5年里,大隅良典仍然经常自己做实验。虽然进入新世纪后,因过了创造力高峰期,并没有像在东京大学时期那样接二连三地取得新的重大研究突破,但他却以其丰富的研究经验培养出了以水岛昇、吉森保为代表的一批优秀的细胞自噬研究学者。正在由于这批年轻学者的接续努力,大隅良典开辟的细胞自噬分子机制研究新领域才得以展示出广泛的应用前景。从这个意义上讲,大隅良典荣获2016年的诺贝尔生理学或医学奖,那既是对其研究贡献的表彰,也是对其育人业绩的肯定。
本文承蒙中国科学院生物物理研究所张宏研究员审阅,并提出了很好的修改建议,特此致谢!
参考文献:
1. 大隅良典. 酵母から見えてきたオートファジーの世界(2012年在第28届京都奖颁奖典礼上的演讲)[DB/OL]. [2016-11-07]. http://www.kyotoprize.org/wp/wp-content/uploads/2016/02/28kB_lct_JP.pdf.
2. 水島昇.オートファジーの現場をとらえる——細胞が自分を食べる理由[DB/OL].生命誌, 2005,45. [2016-11-07].http://www.brh.co.jp/seimeishi/journal/045/research_21.html.
3. 项征,魏平,杨震.泛素调节的蛋白降解[J].今日化学,2005,20(1):8-10.
4. 王海燕,倪涛,谢志平. 酵母中细胞自噬的研究进展[J]. 中国细胞生物学学报, 2010,32(6):829-839.
5. 郭晓强.一位生物化学家的细胞之旅——德迪夫与溶酶体发现[J].科学,2014,66(3):52-55.
6. 周程.日本诺贝尔科学奖出现“井喷”对中国的启示[J].中国科技论坛,2016,(12).
7. 中村桂子. めぐる:生命誌年刊号vol.61-64[M]. 東京:新曜社,2010.
8. 郭晓强. 埃德尔曼:发现抗体机构的科学家[J].科学,2014,66(6):49-52.
9. 大矢禎―.安楽泰宏先生を送る[J].東京大学大学院理学研究科・理学部廣報,1997,28(4):6.
10. Ohsumi Y, Anraku Y. Active transport of basic amino acids driven by a proton motive force in vacuolar membrane vesicles of Saccharomyces cerevisiae[J]. Saccharomyces cerevisiae[J]. Journal of Biological Chemistry, 1981,256(5):2079-2082 .
11. 安楽泰宏. 酵母液胞膜ATPaseの構造と機能[J].帝京科学大学紀要,2005,1:1-12.
12. 日本の研究.com [DB/OL].[2016-11-07].https://research-er.jp/researchers/view/111641.
13. 《日経サイエンス》編集部.細胞の健康守るオートファジー[J].日経サイエンス,2015,(11):54-55.
14. Takeshige K, Baba M, Tsuboi S, Noda T, Ohsumi Y. Autophagy in yeast demonstrated with proteinase-deficient mutants and conditions for its induction [J].The Journal of Cell Biology,1992, 119(2):301-311.
15. Tsukada M, Ohsumi Y. Isofation and characterization of autophagy-defective mutants of Saccharomyces cerevisiae[J]. FEBS Letters,1993,333(1、2):169-174.
16. Mizushima N, Noda T, Yoshimori T,Tanaka Y, Ishii T, George M D,Klionsky D J, Ohsumi M, Ohsumi Y. A protein conjugation system essential for autophagy[J]. Nature, 1998,395:395-398.
17. Ichimura Y, Kirisako T, Takao T,…, Ohsumi Y. A ubiquitin-like system mediates protein lipidation[J]. Nature, 408:488-492.
18. 《每日新闻》编辑部.大隅良典氏:オートファジー研究をリード[N].每日新闻,2014-04-03. [2016-11-07]. http://mainichi.jp/articles/20140403/mog/00m/040/999000c.
欢迎个人转发到朋友圈,
公众号、报刊等转载请联系授权
[email protected]
▼点击查看相关文章
西湖 | 琥珀恐龙 | 学研境界 | 2017科学突破奖
三院士谈科研 | 学术辩 | CUSPEA | 罗德学者
屠呦呦 | 王晓东 | 白岩松 | 何江 | 张锋 | 杨振宁
大隅良典 | 科学队长 | 冬虫夏草 | 艾滋 | 疫苗
狗 | 死 | 吃 | 卢煜明 | 王小凡 | 期刊 | LIGO

▼▼▼点击“阅读原文”,牵手科学队长!















