特约撰稿人
:储旻华
2017年7月6日至7日,科睿唯安生命科学事业部在六朝古都南京,召开了科睿唯安第四届中国制药行业大会:构建2.0时代下中国制药企业的核心竞争力。笔者有幸亲临会场聆听了数十位专家的精彩演讲,现分享个人体会如下。
2015年8月国务院发布《关于改革药品医疗器械审评审批制度的意见》(国发﹝2015﹞44号),提出了总体改革目标。之后我们每一位医药人都经历了政策法规的密集出台,新药研发快速发展和国际合作交易不断涌现的新形势,中国制药行业正在迅速地转型和升级中。因此,新药研发也是本次会议的关注焦点之一。
来自科睿唯安生命科学事业部首席科学家Richard Harrison博士从大数据的层面概述了近年来中国制药行业的变化与发展。根据现场报告的数据,截止去年底,中国的制药行业规模已经高达867.74亿美元,仅次于美国(3396.94亿美元)和日本(940.25亿美元),成为全球第三大市场。科睿唯安的预测显示,到2017年底,中国有望超越日本,成为全球第二大市场市场。
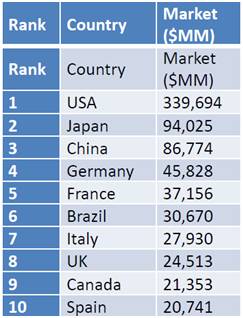
在这一大背景下,中国启动的临床试验数量也从2007年的293个迅猛增长至2016年的1398个,在全球排名第4(前3位分别是美国、日本和德国),在新兴市场遥遥领先。
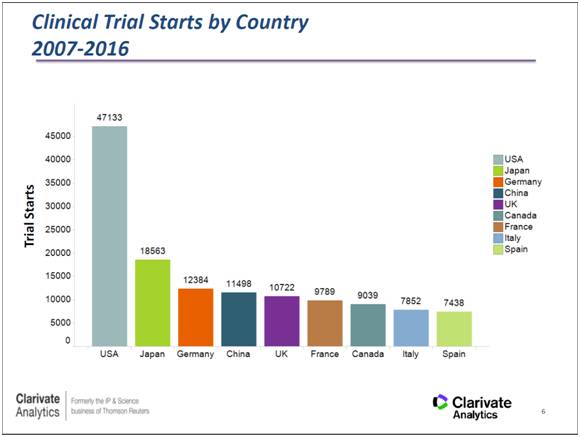
从申办方来看,2007至2016年间,广东中山大学和上海复旦大学的临床试验远超同行,并以II期和IV期为主。从公司来看,这段时间内开展临床最多的公司几乎完全被跨国药企所垄断,令人惊喜的是,国内药企江苏恒瑞超越不少跨国巨头,跻身第三。与其他大公司在华研究以III期为主不同,恒瑞的临床研究主要是I、II、III期都同时展开。
在适应症方面,主要集中在糖尿病(非胰岛素治疗)、乳腺癌、晚期肺癌、乙肝、疼痛、肝癌、胃癌等。而其他新兴市场常见的适应症如类风关,所占比例很小。
在这次会议上,几乎每位专家都提到了监管政策的改变。44号文后,国家出台了很多新政策,包括加快审评审批速度,鼓励创新,鼓励全球多中心同步临床试验等。
不过这些改革带来的并不全是机遇,也有挑战。比如有好几位专家都提到,这些政策一方面加快了国内创新药的临床研究和上市审批,另一方面,国外的创新药同样也能享受到政策利好,因此客观上加剧了竞争。而今年6月19日,CFDA宣布正式成为ICH成员,有机会实现数据互认,加速早期临床开发,但同时也对药品的开发和生产提出了更高的要求。
2016年启动的MAH(药品上市许可人制度)试点使得创新型企业和科研人员也能成为药品上市许可的的持有人,这一试点客观上有利于专注于创新药开发的中小型企业。
在研发环境上,第三军医大学李晓辉教授指出,心血管药物的开发仍旧不容乐观。一方面各大公司包括国际巨头,在心血管适应症上的关注有明显下降,进入门槛提高,从以前的改善急性危险因素,发展到现在的针对长期预防性用药。其次,心血管的临床研究,通常需要一万例以上的大样本研究,甚至更多,需要投入大量的资金和资源。最后,随着新的需求的出现,原来对疾病和靶点的认识显得陈旧,需要科学上的新发现来作为基础。因此,李教授总结,医和药的有机结合非常重要。
天士力控股集团董事局董事、副总裁孙鹤博士就复方丹参滴丸海外研发的实例提出了他的思考,中国现在的新药研发热是真的新药多了还是只是PI的数量增加了?孙博士进一步指出,当前中国的临床试验数据结果还有很大的提升空间。
亚宝药业集团的首席科学家王鹏博士认为,中国还是普遍缺乏好的化合物库,筛选评价技术与西方发达国家有较大的差距,并且缺乏好的成药性药物经验。
恒瑞医药的首席医学官邹建军博士则从临床的角度提出,国内目前好的临床试验中心还是不足,尤其是I期临床中心,以及相应的人才和运营经验。





