

▲第一作者:荣家信; 通讯作者:罗德平教授;姜耀甲教授;
通讯单位: 南京工业大学先进化学制造研究院
论文DOI:10.1021/acscatal.0c00381
全文速览
本文报道了一种廉价金属
Cu(OH)
2
催化,炔酮碳碳叁键断裂重组反应。该反应利用简单的原料,通过碳碳叁键的断裂重组可以高效构建应用广泛的
1,4-醛酮类化合物和环戊烯酮衍生物。
有机合成的目的之一就是从简单易得的原料出发,反应得到高官能团化的目标产物,其中一个重要的挑战就是碳碳键的断裂和生成。与碳碳单键、双键相比,碳碳叁键具有最高的键解离能(>200 kcal/mol),限制了其催化体系的发展。之前对碳碳叁键断裂的研究多集中在化学计量的有机金属参与的反应,如金属络合物中配体的断裂和氧化裂解,这些方法大多具有较差的化学选择性、剧烈的反应条件和底物拓展的局限性。另一个问题是原子经济性,文献报道的碳碳叁键断裂以后,往往只有一端有用,另一端作为副产物存在。因此,迫切需要一种高效的催化体系对碳碳叁键的断裂体系做补充。
(
1
)温和条件下实现碳碳叁键的断裂,并构建高官能团化的产物。
首先,我们使用
LiOH
作为亲核试剂,同时作为一种碱与
N
-
对甲苯磺酰肼反应得到卡宾中间体。具体的反应是底物炔酮
1a
和
N
-
对甲苯磺酰腙
2a,
条件是
2.0
当量的
LiOH
、不同的铜催化剂和
100
o
C
的油浴(表
1
,
entry 2-6
),对照实验表明不加金属催化剂,没有产物的产生(表
1
,
entry 1
)。与一价铜相比,二价铜金属催化剂反应效果较好,且
Cu(OH)
2
具有最高的反应收率
55%
(表
1
,
entry 6
)。对碱的筛选实验表明,
LiOMe
能更高效促进反应的进行(表
1
,
entry 7-9
)。而对溶剂的筛选表明非芳香溶剂不能促进反应的进行(表
1
,
entry 10-12
)。最终我们确定,在
100
o
C
反应温度下,使用
5 mol%
的
Cu(OH)
2
,
2.0
当量的
LiOMe
,同时添加
1.0
当量的
H
2
O
,可以有较好的反应效果,收率
87%
(表
1
,
entry 13
)。
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
a
Experiments were performed with
1a
(0.20 mmol, 1.0 equiv.) and
2a
(0.40 mmol, 2.0 equiv.) in presence of metal catalysts (10 mol %), base (0.20 mmol, 2.0 equiv.) and H
2
O (0.10 mmol, 1.0 equiv.) in solvent (4 mL) with stirring at 100
o
C under argon atmosphere until
1a
was completely consumed.
b
Isolated yields.
c
5 mol % catalyst-loading. Cu(OTf)
2
= copper (II) trifluoromethanesulfonate; DCE = 1,2-dichloroethene.
|
|
反应的底物范围研究
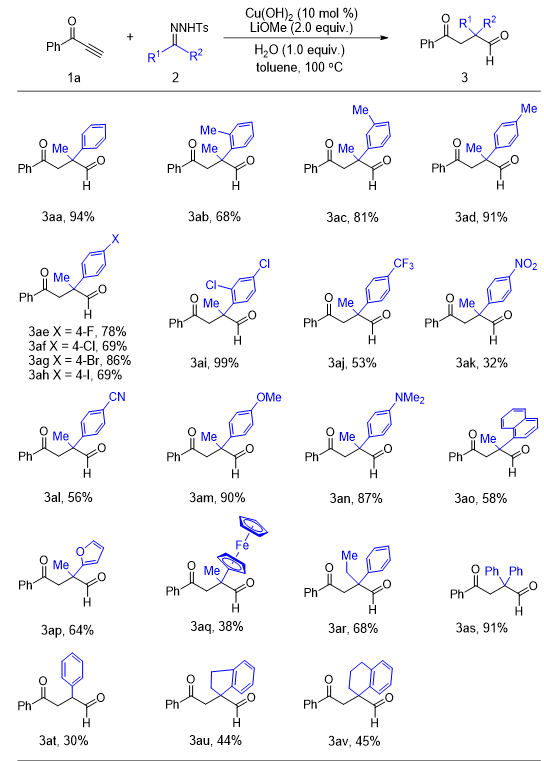
a
Unless otherwise noted, the reactions were carried out using
1a
(0.20 mmol, 1.0 equiv.) and
2
(0.40 mmol, 2.0 equiv.) in the presence of Cu(OH)
2
(10 mol %), LiOMe (0.40 mmol, 2.0 equiv.) and H
2
O (0.20 mmol, 1.0 equiv.) in toluene (0.05 M, 4 mL) at 100 °C under argon atmosphere.
b
Isolated yields.
▲图1
N
-对甲苯磺酰腙的底物拓展
a,b
在掌握了反应的最优条件之后,我们首先对
N
-
对甲苯磺酰肼进行反应适用性研究。实验表明,芳环、烷基取代的
N
-
对甲苯磺酰腙有中等以上的反应收率。具体来说,苯环上有邻、间和对甲基取代时,收率分别是
68%
、
81%
和
91%
(图
1,3ab
、
3ac
和
3ad
),芳环上有卤素(
F
、
Cl
、
Br
和
I
)时,反应都有较好的官能团耐受性。之后我们对电子效应进行研究,发现苯环上有给电子基团时,与吸电子基团相比,有明显高的反应收率(图
1,3aj-3an
)。
同时,萘环和杂环也能以中等的收率得到目标产物(图
1,3ao
、
3ap
)。值得注意的是,二茂铁取代的
N
-
对甲苯磺酰腙在标准件下也可以
38%
的收率得到含铁的目标产物(图
1,3aq
),这表明,目前的催化体系对于金属络合物具有一定的反应适用性。为了对甲基的
N
-
对甲苯磺酰腙底物做补充,我们分别使用乙基和双苯环的底物进行反应,反应效果显著,收率分别是
68%
和
91%
(图
1,3ar
、
3as
)。最后,我们发现对于醛和苯并环酮得到的底物,反应条件同样有适用性,得到官能化的
1,4-
二羰基产物(图
1,3at-3av
)。
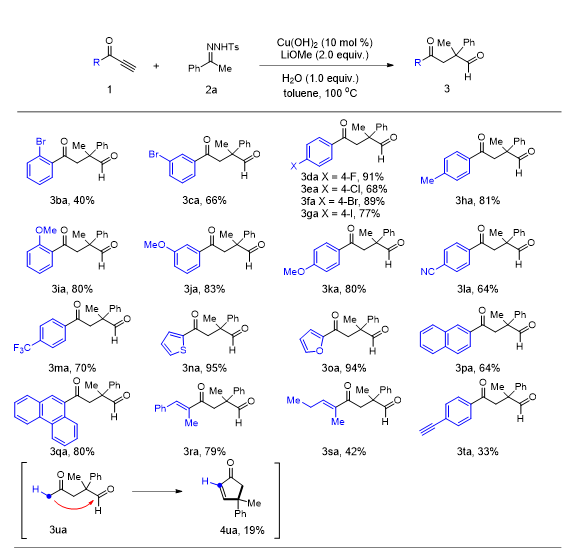
a
Unless otherwise noted, the reactions were carried out using
1a
(0.20 mmol, 1.0 equiv.) and
2
(0.40 mmol, 2.0 equiv.) in the presence of Cu(OH)
2
(10 mol %), LiOMe (0.40 mmol, 2.0 equiv.) and H
2
O (0.20 mmol, 1.0 equiv.) in toluene (0.05 M, 4 mL) at 100 °C under argon atmosphere.
b
Isolated yields.
之后,我们对炔酮进行反应适用性研究。实验表明,芳环上不同取代基(如
X
、
Alkyl
、
CN
、
MeO
和
CF
3
)的炔酮有普遍较高的反应效果。具体来说,苯环上有邻、间和对溴取代时,目标产物
1,4-
二羰基化合物的收率分别是
40%
、
66%
和
89%
(图
2,3ba
、
3ca
和
3fa
)。炔酮取代基的电子效应同样对反应存在影响,苯环上有给电子基团适用性好于吸电子基团(图
2,3ia-3ma
)。我们使用噻吩和呋喃的炔烃进行杂环底物的研究,发现收率较高(图
2,3na,3oa
)。当使用稠环的炔烃进行反应时,反应同样有较好的适用性,收率为
64%
和
80%
(图
2
,
3pa,3qa
)。此外,我们得到了
C-C
双键、
C-C
叁键选择性反应的结果(图
2,3ra-3ta
)。有趣的是,当我们对底物是甲基的炔酮
1u
进行研究时,发现并没有得到
1,4-
二羰基的产物
3ua
,而得到了少量分子内
Aldol
羟醛缩合产物环戊烯酮。
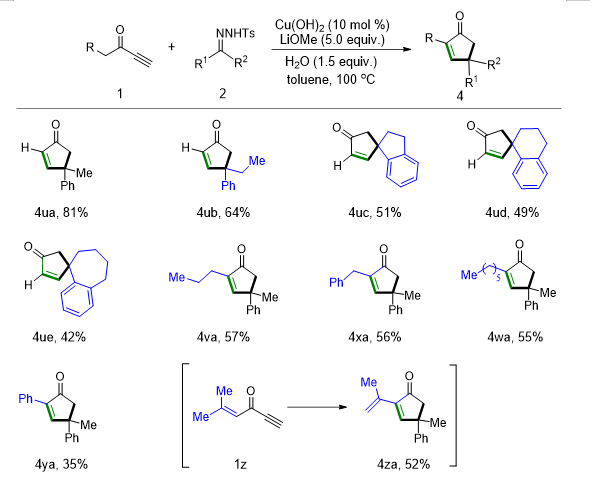
a
Unless otherwise noted, reactions were carried out using
1
(0.20 mmol, 1.0 equiv.) and
2
(0.40 mmol, 2.0 equiv.) in the presence of Cu(OH)
2
(10 mol %), LiOMe (0.40 mmol, 5.0 equiv.) and H
2
O (0.30 mmol, 1.5 equiv.) in toluene (0.05 M, 4 mL) at 100 °C under argon atmosphere.
b
Isolated yields.
环戊烯酮化合物是药物合成中一类重要的有机分子骨架,对其每个碳原子的修饰以及官能化是构建天然产物以及衍生物的重要方法。我们惊喜地发现,
Cu(OH)
2
催化体系可以从简单的底物烷基炔酮和
N
-
对甲苯磺酰腙出发,一锅法串联反应得到环戊烯酮衍生物。经过简单的条件修饰我们发现,可最高以
81%
的收率得到十个环戊烯酮化合物(图
3
,
4ua-4za
)。
其中,
4ud
、
4ue
有较低的收率主要是由于
N
-
对甲苯磺酰腙的分解以及自身的偶联反应。环状的
N
-
对甲苯磺酰腙相应得到非手性螺环的环戊烯酮骨架(图
3
,
4uc-4ue
)。值得注意的是,共轭烯烃的底物炔酮
1z
,在该条件下,可以以中等的收率得到
C-C
双键移位的环戊烯酮产物
4za
。
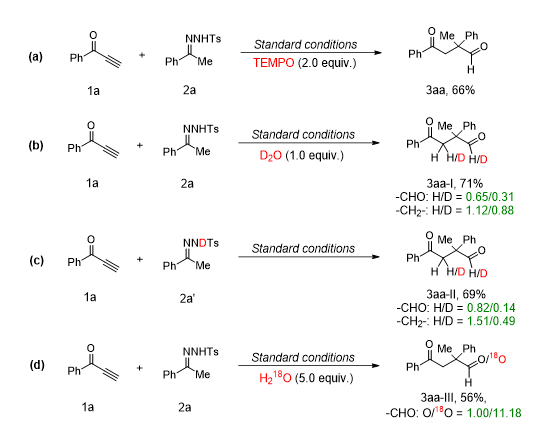
▲图
4
控制实验
在完成了底物拓展的基础之上,我们对反应的机理进行摸索。首先,我们向反应和额外添加了
2.0
当量的自由基捕捉剂
2,2,6,6-
四甲基
-1-
哌啶酮(
TEMPO
),反应的收率只有较低的下降(图
4
,方程式
a
),说明反应并不是经过自由基的机理。其次,我们分别作了
D
2
O
和
D-N-
对甲苯磺酰腙的同位素标记实验,均得到了同位素标记的目标产物(图
4
,方程式
b,c
)。最后,我们向反应中加入过量的
H
2
18
O
,实验得到了醛基
18
O
标记的产物(图
4
,方程式
d
)。以上实验说明最后水解过程的
H
2
O
有可能是底物
N
-
对家苯磺酰腙原位生成的。
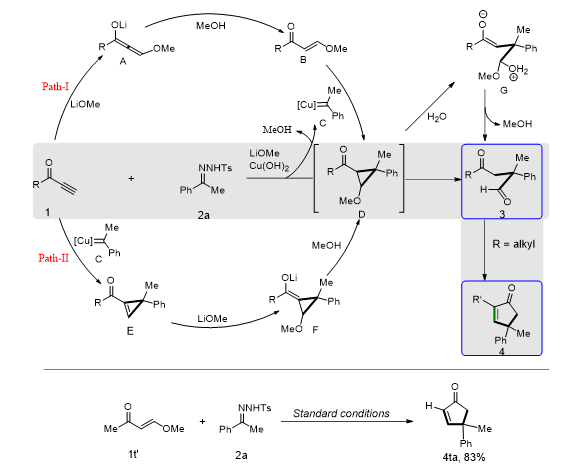
▲图
5















