相关链接:
PPT课件-药品生产过程控制与风险管理
药品生产关键工艺控制
从风险原则出发,确定关键控制点

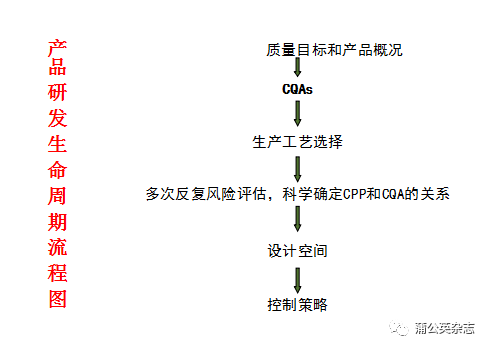
研发过程的CQA研究-以某片剂为例
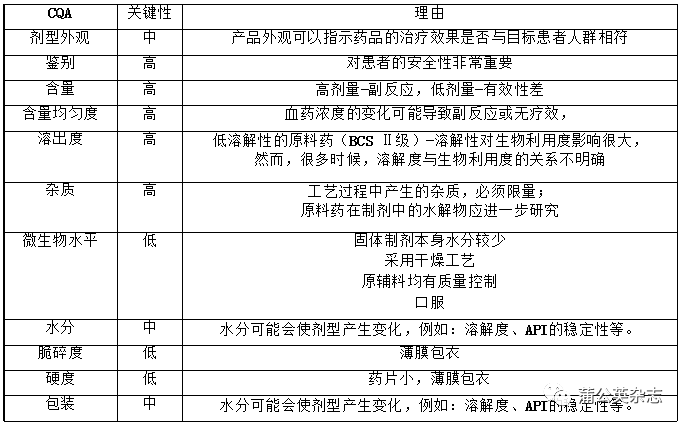
通过CQA寻找潜在的关键参数和关键区域-以某片剂为例
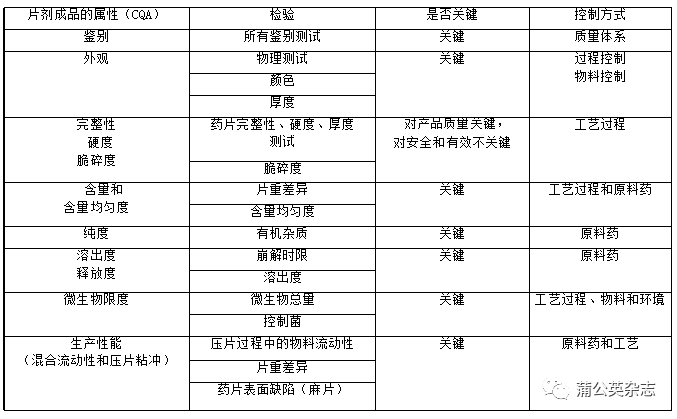
找出生产品种需要控制的关键工艺步骤,针对关键工艺步骤重点采取措施。
关注关键属性的风险管理方法
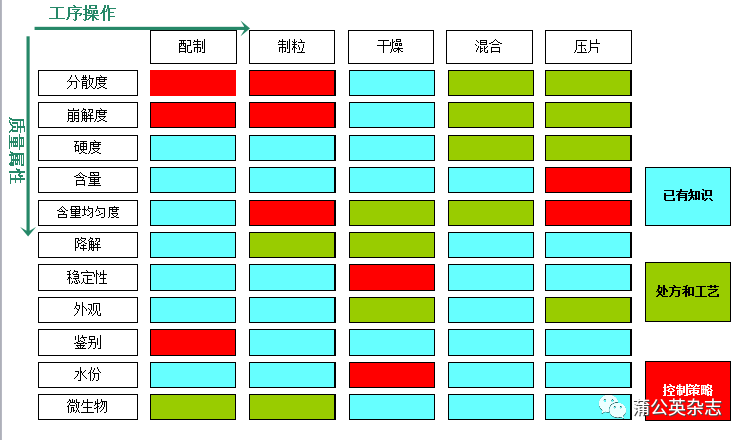
考虑患者风险


生产过程控制系统的建立
过程控制的目的:
为了确保产品质量满足质量标准要求,对生产过程中影响产品质量的各个因素进行控制。
过程控制的基础:
工艺规程
工艺流程及要求;
各工序所需要的设备;
工艺参数;
生产环境要求;
检验步骤及标准。
所有工艺规程必须经过工艺验证,合格后方可用于正式生产。
过程控制的职责
生产部门:制定工艺规范,负责实施生产、过程检验及监控。
生产技术部门:从技术角度对工艺规范进行审核。
工程、维修部:负责按要求为生产提供适宜的环境,负责测量设备校验及设备预防维修管理工作。
Q A:从质量保证角度对工艺规范进行审核并检查其实施情况,参与偏差过程的处理,审核批生产记录及相关记录,负责各类生产文件的控制及批记录存档工作。
Q C:负责中间体、半成品及成品的检验工作。
过程控制的时机与控制重点-生产前
生产现场检查。生产现场已按标准清洁程序进行了清洁,任何部位都不允许有与即将生产的产品无关的物料。
生产环境检查。生产环境(如:温度、湿度、洁净度等)应符合生产工艺要求。
生产设备检查。生产设备的各项功能符合生产要求。
生产物料检查。生产所使用的原辅料、半成品、包装材料等,其种类及数量应符合生产工艺要求。
生产参数检查。直接影响产品质量的工艺参数设置应符合工艺文件规定。
生产文件检查
过程控制的时机与控制重点-生产中
应定期对生产现场、环境、物料、生产设备及工艺参数设置进行再确认,已确保以上生产条件始终符合生产工艺要求。
产品质量检查:生产过程中应定期对所生产的产品质量特性进行检查和监控,检查结果应符合过程控制标准及产品质量标准,对于一些特殊的质量特性( 如:片重、灌装量等)应采用X-R控制图(均值—范围质控图)的形式对其波动情况进行监控,以确保工序始终处于稳定状态。
定期检查相关的记录,要清晰、完整、正确。
过程控制的时机与控制重点-生产结束
应按标准清洁程序对生产现场及设备及时进行清洁,剩余物料及废弃物料按规定移出生产现场。
保证生产所使用的物料流向正确,生产结束后应对所使用的原辅料、中间体、半成品、成品及有印刷文字的包装材料数量进行平衡,平衡结果应符合规定要求。
特殊过程的过程控制
对于非固体制造、固体造粒工艺,灭菌等工艺由于封闭型生产,其中每一工序的制造结果无法及时通过随后的检验来确认,只能等到整个制备过程结束后才能进行检验,故这些制造工艺过程属于特殊过程。
这些过程必须由具备相应资格的操作者来完成;
控制整个制备工艺的设备及计算机系统必须经过验证;
生产过程中操作者必须对工艺参数进行监视和控制,以确保满足规定要求。过程打印数据应附在批记录上。

产品回收
回收:在某一特定的生产阶段,将以前生产的一批或数批符合相应质量要求的产品的一部分或全部,加入到另一批次中的操作。
需经预先批准,并对相关的质量风险进行充分评估,根据评估结论决定是否回收。
除非:
△潜在的风险已被评估,不会影响最终产品质量
△符合质量标准
△批准的操作规程
△保存记录
△新批号(以最早批次产品的生产日期确定有效期)
由QC进行额外检验和稳定性考察
尾料:药品制剂生产过程中,由于生产设备的限制,一批正常生产、符合各项中间控制质量标准的产品在某一特定生产工段无法全部加工完的剩余产品,如压片结束时残留在压片机内的剩余颗粒,中药丸剂挤丸时的剩余坨料等。如需继续对剩余颗粒或坨料进行压片或挤丸,则片重和丸重无法控制在规定限度内。
经确认或验证以证实尾料为合格物料,可以回收。
物料和溶剂的回收
回收反应物、中间产品或原料药(如从母液或滤液中回收),应当有经批准的回收操作规程,且回收的物料或产品符合与预定用途相适应的质量标准。
溶剂可以回收。回收的溶剂在同品种相同或不同的工艺步骤中重新使用的,应当对回收过程进行控制和监测,确保回收的溶剂符合适当的质量标准。回收的溶剂用于其它品种的,应当证明不会对产品质量有不利影响。
未使用过和回收的溶剂混合时,应当有足够的数据表明其对生产工艺的适用性。
回收的母液和溶剂以及其它回收物料的回收与使用,应当有完整、可追溯的记录,并定期检测杂质。
返工
将某一生产工序生产的不符合质量标准的一批中间产品或待包装产品、成品的一部分或全部返回到之前的工序,采用
相同的生产工艺
进行再加工,以符合预定的质量标准。
不合格的制剂中间产品、待包装产品和成品一般不得进行返工。只有不影响产品质量、符合相应质量标准,且根据预定、经批准的操作规程以及对相关风险充分评估后,才允许返工处理。返工应有相应记录。
质量管理部门应当考虑需要进行额外相关项目的检验和稳定性考察。除非已经过验证和稳定性考察。
原料药返工
不符合质量标准的中间产品或原料药可重复既定生产工艺中的步骤,进行重结晶等其它物理、化学处理,如蒸馏、过滤、层析、粉碎方法。
多数批次都要进行的返工,应当作为一个工艺步骤列入常规的生产工艺中。
除已列入常规生产工艺的返工外,应当对将未反应的物料返回至某一工艺步骤并重复进行化学反应的返工进行评估,确保中间产品或原料药的质量未受到生成副产物和过度反应物的不利影响。
经中间控制检测表明某一工艺步骤尚未完成,仍可按正常工艺继续操作,不属于返工。
重新加工














