西那普肽脂质体气溶胶体外评价
In vitro Evaluation of Sinapultide Liposomal Aerosols
邱瑞琪,陆伟根*
(中国医药工业研究总院药物制剂国家工程研究中心,上海 201203)
摘要:
制备并评价了西那普肽脂质体。冻干前后脂质体的平均粒径、ζ 电位和包封率分别为556.5 和651.2 nm、-56.8 和
-41.6 mV、83.8%和70.4%。冻干脂质体中残余水分含量为1.48%,氯仿和甲醇的残留量低于中国药典2015年版的限度要求。利用Pari 雾化器将用生理盐水复溶后的西那普肽脂质体雾化,形成气溶胶,再分别采用双级撞击器、新一代撞击器(next generation impactor,NGI)、飞行时间(time-of-flight,TOF) 空气动力学粒径谱仪对气溶胶的体外沉积性质进行考察。结果表明,双级撞击器、NGI 和TOF 测得的体外沉积性质相似;双级撞击器和NGI 测得空气动力学粒径小于6.4 μm 的脂质体气溶胶中的西那普肽含量占总药量的比例为50.86%和43.87%,NGI 和TOF 测得的空气动力学质量中位径(mass median aerodynamic diameter,MMAD) 值为3.09 和2.81 μm。这些结果提示西那普肽脂质体气溶胶能够在肺部沉积,具有较好的开发应用前景。
关键词:
西那普肽;脂质体;冻干;气溶胶;体外评价;粒度分布;雾化;空气动力学
肺表面活性物质(pulmonary surfactant,PS)
由Ⅱ型肺泡细胞合成、贮存与分泌,其组成为:80%~ 90%磷脂,8%~ 10%蛋白质,10%中性脂及少量的无机盐。磷脂中卵磷脂的含量最高,其中在降低表面张力方面起作用的主要是饱和卵磷脂,如二棕榈酰卵磷脂(dipalmitoyl phosphatidylcholine,DPPC) [1]。在周期性呼吸运动中,表面活性蛋白(surfactant protein,SP) 促进磷脂向液体表层吸附和分布,从而降低表面张力,其中疏水性蛋白SP-B和SP-C 功能最强。二者独立发挥生理效应,相互无协同作用。与SP-C 相比,SP-B 的功能更强。因此,尽管DPPC 及磷脂酰甘油是构成PS 的主要磷脂成分,但PS 的生物活性主要取决于疏水性SP-B[2]。如果肺泡Ⅱ型细胞发育不成熟,不能分泌足够的PS,将会导致新生儿出现严重的呼吸衰竭,易引发发病率和致死率均极高的新生儿呼吸窘迫综合征(newborn respiratory distress syndrome,NRDS)。
目前,治疗NRDS 的主要方式为气管内注射外
源性PS。然而,气管内注射需要先进的设备及熟练的技巧,且会对新生儿带来机械性创伤,并易引发心动过缓、低血压等并发症[ 3]。研究表明,气溶胶是一种有效的给药方式[ 4]。因此,许多新生儿重症监护室已经改变治疗策略:将外源性PS 以气溶胶的形式给药,不仅能避免机械性创伤,并且降低对设备和给药技巧的要求。
西那普肽( sinapultide,1) 是一种模拟人类
SP-B 的含21 个氨基酸的疏水性多肽( 亮氨酸、赖氨酸重复序列) [5],由DPPC、1- 棕榈酰基-2- 油酰基磷脂酰甘油钠盐(phosphatidylglycerole-Na,POPG-Na)、棕榈酸(palmitic acid,PA) 和1 组成
的药物芦西那坦(lucinactant) 在治疗NRDS 上的安
全性及有效性已得到证实[ 6—7]。冷冻干燥可有效避免热敏性药物变性或失去生物活性[8],并且1 脂质体以气溶胶的形式给药可避免对新生儿的机械性创伤及引发的并发症,且在雾化过程中1 的活性保持不变[9]。
本研究利用空气压缩泵驱动雾化1 脂质体混悬
液形成气溶胶,并对气溶胶特性进行评价,从而为其开发应用提供一定的参考。
1 仪器与试药
2 方法与结果
2.1 1 含量的HPLC 测定法
色谱柱 YMC-Pack Pro C4 柱(4.6 mm×250 mm,
5 μm); 流动相 A 为含0.2 mol/L 高氯酸钠和0.025 mol/L 氯化钾的溶液( 用高氯酸调至pH 1.88),B 为乙腈,梯度洗脱( 程序见表1);柱温 45 ℃;流速 1 ml/min;检测波长 210 nm;进样量 20 μl。
采用外标法。以浓度( c) 为横坐标,峰面积(A)
为纵坐标,线性回归,得回归方程A= 7 576.8c+8 970.6,R2=0.999 9,线性范围为1 ~ 1 200 μg/ml。加入至5 倍有机相体积、pH 7.2 的Tris 缓冲液中,超声后分装于棕色小瓶中,冻干。
2.3 1 脂质体包封率的测定方法
采用超速离心法测定脂质体的包封率。取脂
质体混悬液1.0 ml,加入甲醇0.5 ml,25 ℃离心(15 938×g)20 min。取上清液0.5 ml 置10 ml 量瓶中,加入甲醇定容,取样测定,按“2.1”项下HPLC方法检测,计算游离1 浓度为c 游。另取相同的脂质体混悬液1 ml 置离心管中,加入乙腈2 ml 破乳,然后加甲醇定容至10 ml,进样分析,计算1 总浓度为c 总。计算包封率=(1-c 游/c 总)×100%。
2.4 1 脂质体的评价
2.4.1 1 脂质体的表征
采用激光衍射法测定未冻干前1脂质体的粒径、
多分散系数(PDI) 值和ζ 电位。平行测定3 批,结果1 脂质体的平均粒径为(556.5±7.4)nm,PDI 值为(0.035±0.002),平均ζ 电位为(-56.8±3.2 )mV( n=3)。粒子表面电位的大小与其稳定性具有较强的相关性:ζ 电位的绝对值越大,粒子之间的排斥力越大,也就越稳定[12]。因此提示1 脂质体混悬液的稳定性较好,不易发生聚集或分层现象。按“2.1”项下HPLC 法测得1 脂质体的平均包封率为(83.8±2.1)% (n=3)。
2.4.2 1 脂质体的残余水分测定
冻干后残余水分的含量往往会影响多肽蛋白质
药物的稳定性[14],因此残余水分的测定显得尤为重要。本试验采用Karl Fisher 法测定冻干后脂质体中残余水分的含量。美国生物制品规程中规定,用Karl Fisher 法测定残余水分一般应低于3% [15]。
2.4.3 1 脂质体残留有机溶剂的测定
由于1 脂质体的制备过程中使用了甲醇、氯仿,
根据人用药品注册技术要求国际协调会和中国药典2015 年版的要求,必须对其残留溶剂进行控制。本试验采用气相色谱法测定其有机溶剂残留量。
2.4.3.1 气相色谱条件
色谱柱 Agilent OB-WAX 柱(30 m×0.32 mm×
0.25 μm);升温程序 40 ℃维持3.5 min,然后以40 ℃ /min 升温至240 ℃,维持5 min;检测器温度200 ℃;进样口温度 150 ℃;进样量 1 μl;载气参数 H2 70 ml/min,N2 100 kPa。采用内标法计算有机溶剂含量。将乙腈溶于二甲亚砜(DMSO) 中,配制成乙腈浓度为50 μg/ml 的内标溶液。以浓度c 为横坐标,峰面积之比A甲醇/A乙腈为纵坐标,线性回归,得甲醇的回归方程为A甲醇/A乙腈=0.011 3c-0.014 5,R2=0.999 5,线性范围为5 ~ 100 μg/ml。以浓度c为横坐标,峰面积之比A氯仿/A乙腈为纵坐标,线性回归,得氯仿的回归方程为A氯仿/A乙腈=0.003 3c−0.039 9,R2=0.999 2,线性范围为1 ~ 100 μg/ml。
2.4.3.2 样品处理
精密称取冻干后1 脂质体样品约100 mg,置
10 ml 量瓶中,加入适量内标溶液,超声15 min,再加内标溶液定容,离心( 3 187×g)15 min,取上清液,待测。
2.4.3.3 1 脂质体残留溶剂测定结果
采用“2.4.3.1”项下气相色谱条件,测定冻干
后1 脂质体中氯仿和甲醇的残留量,结果表明,1脂质体中氯仿和甲醇的平均残留量为(2×10-4±3.56×10-6)%和(5×10-4±7.75×10-6)% (n=3),均在中国药典2015 年版四部及ICH 限度要求( 氯仿为0.006%,甲醇为0.3% ) 之下。
2.5 1 脂质体气溶胶的空气动力学特性
室温( 20 ℃ ) 条件下将冻干脂质体用生理盐
水复溶,采用Pari 雾化器使1 脂质体雾化成气溶胶,分别使用双级撞击器、新一代撞击器(next generation impactor,NGI) 及TOF 空气动力学粒径谱仪对形成的1 脂质体气溶胶的体外沉积性质进行考察。
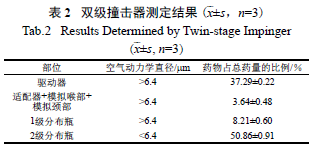
2.5.1 双级撞击器测定法
照中国药典2015 年版四部附录0951 所示方法
进行,试验温度为20 ℃,相对湿度(RH) 为 46%。调节装置入口处的气体流量为60 L/min,测定空气动力学粒径小于6.4 μm 的气溶胶中的药量占总药量的百分比(FPF<6.4 μm)。接收液为甲醇,一级瓶中加7 ml,二级瓶中加30 ml。用甲醇分别洗涤驱动器,适配器、模拟喉部、模拟颈部,一级分布瓶和二级分布瓶,洗液分别加至10、10、25 和50 ml 量瓶中,加甲醇定容,按“2.1”项下HPLC 法测定每一沉积部位的药量,计算各部位药量占总药量的百分比。结果表明,Pari 雾化器雾化1 脂质体复溶液(20 ℃ )2 ml 所需时间为( 185±11) s,雾化速率为( 0.65±0.04)ml/min。双级撞击器测定结果见表2,其中FPF<6.4 μm 为(50.86±0.91)%。