
焦磷枸橼酸铁是由Rockwell公司研发,按照505(b)(1)途径向FDA提出申请,于2015年1月23日在美国获得批准上市。主要用于治疗慢性肾病透析患者的铁损失。该药物具有独特的设计特点:患者每次透析过程中可能损失5-7mg的铁,焦磷枸橼酸铁可加入到碳酸氢盐浓液中,在透析过程中与透析液同步给药,补充由透析造成的铁损失,减少了静脉补铁的频次。
本文旨在通过FDA审评综述中FDACMC审评员与申请人之间的沟通提问,来透视本品种开发的药学关键点,为我们今后研发此类创新药、改良型新药或者仿制药提供有价值的参考信息。
在开始介绍FDA CMC审评员与申请人之间沟通提问的内容之前,我们先透过FDA审评综述(Review),了解一下审评综述中提供的关于焦磷枸橼酸铁药物的技术信息细节,为审评员与申请人之间的沟通内容做以铺垫。
1、药物产品基本信息
(1)中文名称:
焦磷枸橼酸铁溶液(SFP)
(2)英文名称:
Ferric pyrophosphate citrate solutionTriferic
(3)商品名:
Triferic®
(4)适应症:
TRIFERIC用于替代铁,以维持血液透析依赖型慢性肾脏疾病(HDDCKD)患者的血红蛋白。
(5)剂型:
透析用溶液(需要额外的碳酸氢盐浓溶液)
(6)规格:
27.2mg Fe(III)/5mL(即5.44mg Fe(III)/mL)
(7)用法:
将Triferic®1支加入到碳酸氢盐浓溶液(2.5gal,即9.46L)中,再加入到透析液中。在透析液中Fe(III)的终浓度为2μM (110μg/L)(即27.2mg iron/247.5L透析液)。
2、活性成分基本信息
(1)活性成分:
焦磷枸橼酸铁
(2)分子式:
(Fe
+3
)
4(
C
6
H
5
O
7
-4
)
3
(P
2
O
7
-4
)
3
(3)分子量:
1301.4 amu
(4)相对分子量:
大约1312.15Da
(5)化学结构:
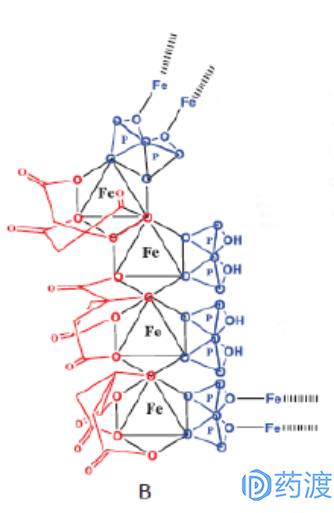
图1. 焦磷枸橼酸铁化学结构片段单元
焦磷枸橼酸铁是由焦磷酸盐和柠檬酸盐配体包围的铁离子形成的八面体配位。活性部分被认为是四个复合物组成的序列,这些序列复合体共享焦磷酸盐和柠檬酸盐。活性部分通过MS、X-Ray、元素分析和铁含量来确证。
(6)理化性质:
黄绿色,易溶于水(>85g/L),完全溶解于大多数有机溶剂(甲醇、丙酮、THF、DMF、DMSO)。5%水溶液的pH值约为6。
3、FDA审评综述中提供的技术信息细节
(1)合成工艺:
没有透漏任何细节(合成工艺相关全部被遮挡),原料和制剂不涉及FDA认定的不寻常的生产工艺单元、创新的生产工艺步骤和不寻常的控制策略。
(2)处方组成:
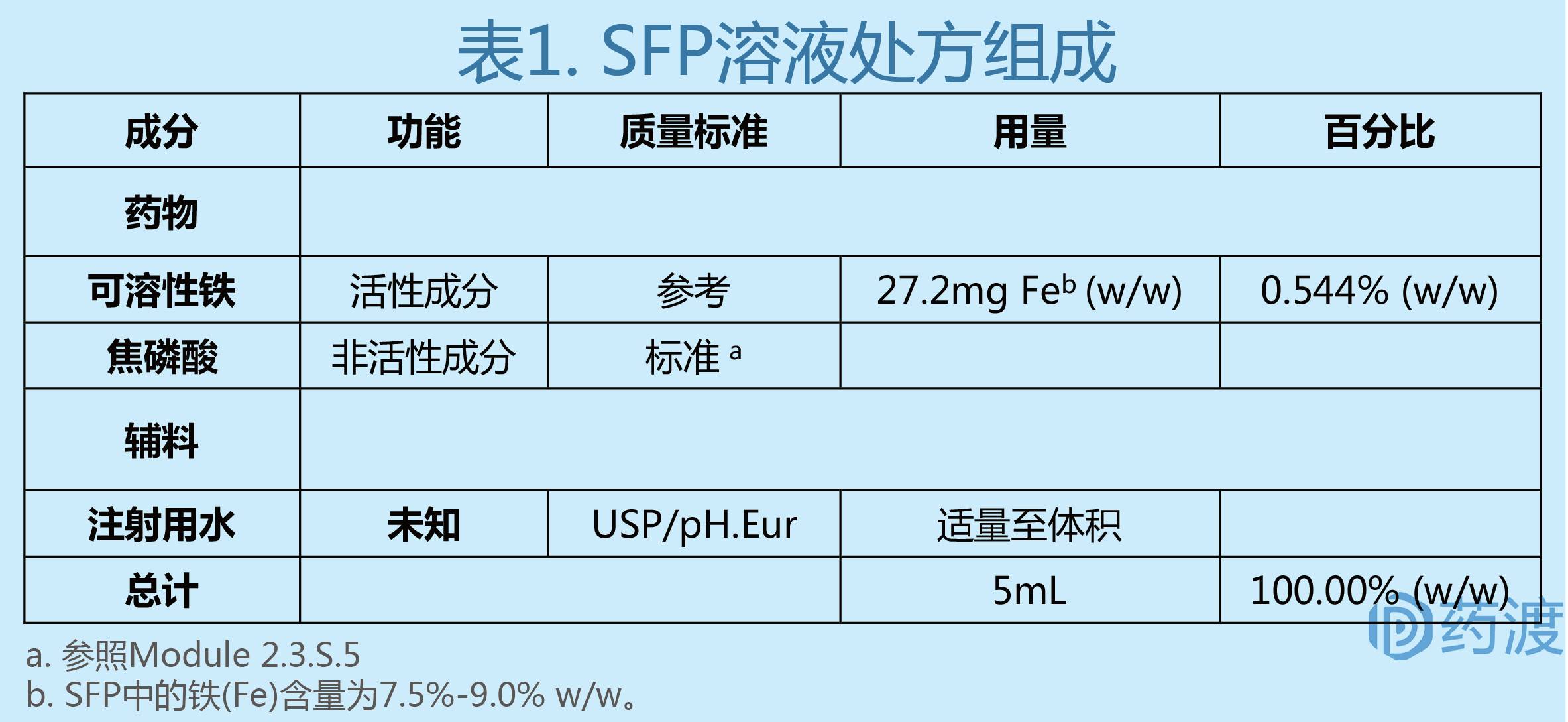
(3)外观:
SPF是含有5.44mg Fe/mL+注射用水(USP标准)的澄清、绿色或黄绿色的无菌溶液。
(4)包装:
安瓿(低密度聚乙烯)是主要包装,安瓿包装外面没有油墨印记或其他附属物。安瓿外面套有铝复合膜(材质具体信息不详),为塑料安瓿提供光保护。最外面用纸盒包装。塑料安瓿和铝袋的材料做了提取和浸出试验。
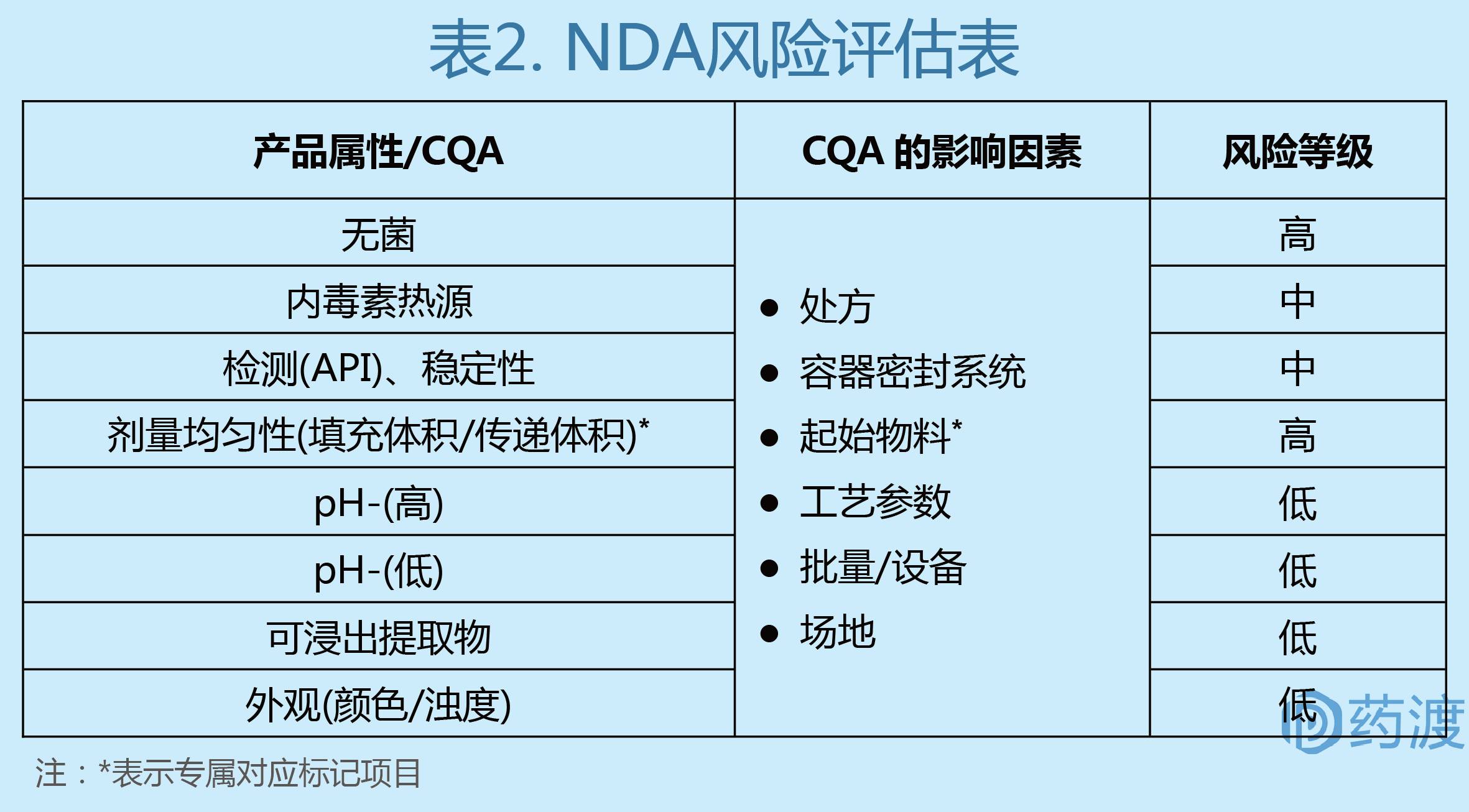
(5)产品CQA信息及风险评估
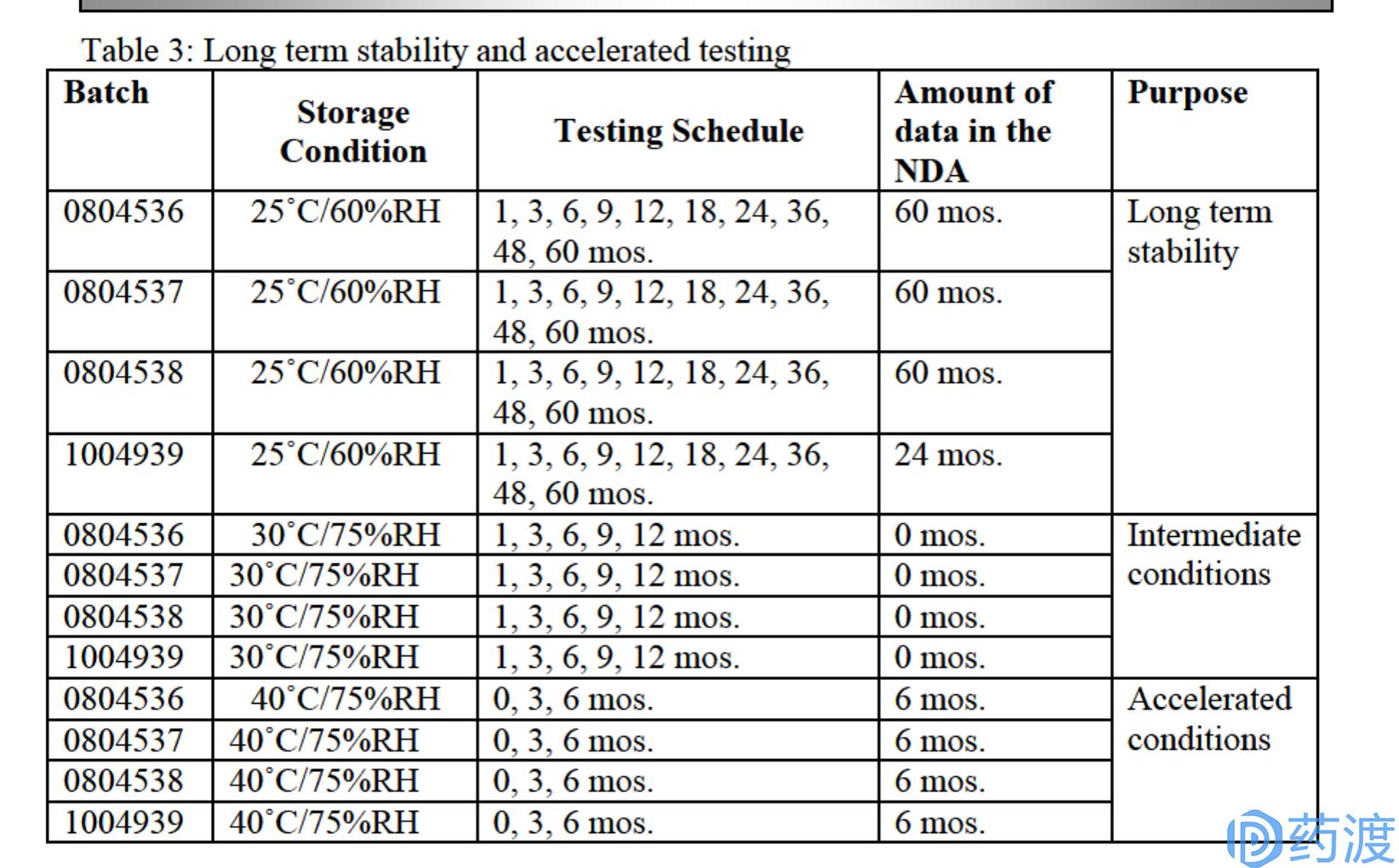
(6)稳定性情况
①有效期:24个月(20-25℃),允许偏移至15-30℃(但在指定的包装系统中)
②开展了室温下SFP+碳酸氢盐浓溶液的24h使用稳定性研究。
表3. SFP溶液稳定性试验方案
药物原料药问题:
1、申请人完全没有提供产品的物理和化学信息。申请人指出无法获得熔点范围、pKa、pH溶解度特征、粒径、分配系数和吸湿性。但这些信息相对容易获得,应当提供。
解读:
尽管相对于小分子化学药物,SFP的结构复杂,分子量大,给药途径简单,但
FDA仍然要求申请人补全产品中活性成分的理化性质参数,特别是pH溶解度特征,FDA认为很重要。
2、药物标准中没有包括其他铁产品中含有的杂质XX的检查项目
解读:
审评员指出的这个杂质的具体信息被FDA屏蔽掉了,但是透露给我们这个杂质是其他铁产品中含有的杂质这个重要的线索。根据经验来说,低分子量铁(Low Molecular Weight Iron)或不稳定铁(Labile Iron)是铁制剂产品中普遍存在并且要求严格控制的杂质。因此推断审评员所指的杂质很可能就是这两种杂质之一。














