PLIVENSIA™(Sirukumab)治疗关节炎的申请未获得关节炎顾问委员会的认可
8月3日,美国,Janssen Biotech公司今日宣布FDA关节炎顾问委员会(Arthritis Advisory Committee)并不推荐将
PLIVENSIA™(Sirukumab)
用
于中重度活动性类风湿性关节炎的治疗。日前咨询委员会对Sirukumab的临床疗效和安全数据进行了认真的审议和讨论,并一致通过了对有效性数据的支持,但在药物安全方面存在不同和不确定性意见,因此暂不推荐该药获批。公司负责人Newman Yeilding对现有结果表示失望并对委员会的不同意见持保留态度,后续还将继续进一步对该审查进行讨论。
PLIVENSIA™(Sirukumab)是一种能够靶向IL-6炎症因子的单克隆抗体药物,可以有效阻断IL-6信号通路的信号转导,从而抑制相关炎症。
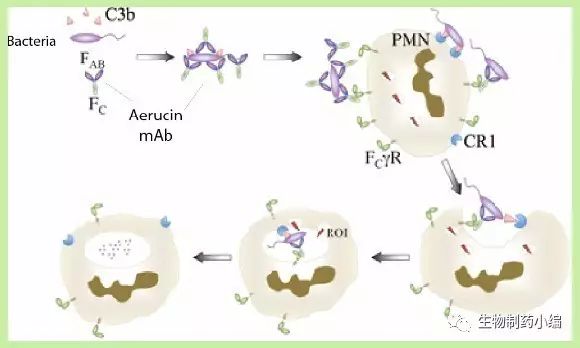
AridisPharmaceuticals公司所开展的治疗急性肺炎的Aerucin®临床试验已经有第一位病人入组
8月2日,美国,Aridis Pharmaceuticals公司今日宣布其正在全球范围内积极招募患者,进行一项治疗由绿脓杆菌感染引起的急性肺炎的临床试验,旨在评价其在研的具有广谱活性的单克隆抗体药物Aerucin®的临床疗效,目前该项研究已经有第一位患者入组。这是一项在全球14个中心开展的随机、双盲、对照研究试验。
Aerucin®是一种人源化的IgG1抗体药物,可以与细菌表面多糖分子藻酸盐相结合,随后可增强免疫系统对于细菌的识别和清除。前期的数据证实该药物对于多种细菌都具有广泛的抗菌活性,包括常见的耐药菌株。急性感染的模型试验证实,Aerucin®的治疗可以降低小鼠急性感染死亡的风险。
Glenmark Pharmaceuticals公布了用于治疗过敏性皮炎的
单克隆抗体GRB830
临床试验的阳性数据结果
8月1日,Glenmark Pharmaceuticals公司今日宣布其开展的治疗过敏性皮炎的2期临床试验取得突破,该公司在研的抗OX40单克隆抗体GRB830对于过敏性皮炎疗效显著。试验数据显示,该药物在安全性、生物活性以及临床疗效方面均优于参比药物。为进一步证实其临床疗效,后续更大样本群的临床试验将会在明年年初开展。
OX40是一种表达于T细胞表面的免疫检查点受体。刺激信号是T细胞行使功能的必要条件,OX40和OX40L的相互结合在自身免疫性疾病中起到关键作用,该通路信号的激活可以引导T细胞转化为记忆T细胞从而诱发炎症,相反抑制这一信号就能抑制相应的免疫反应过程,而GRB830的作用正在于此。
BMS的Opdivo (Nivolumab)获批用于转移性结直肠癌的治疗
8月1日,美国,BMS今日宣布FDA批准了Opdivo(Nivolumab)新的适应症可用于那些微卫星不稳定或存在修复缺陷的转移性结直肠癌的治疗。此次的加速审批是基于新提交的疾病总反应率和持续时间的数据,因为进一步的验证试验已经证实其在该阶段的临床效益。与此同时,最新的NCCN指南(NCCN Clinical Practice Guidelines inOncology)指出Nivolumab (OPDIVO)可作为转移性结直肠癌的二三线治疗用药。
Acceleron治疗腓骨肌萎缩症的
在研抗体药物ACE-083
临床试验已经有第一位病人入组治疗
8月1日,美国,Acceleron Pharma Inc公司今日宣布该公司在研抗体药物ACE-083治疗腓骨肌萎缩症的2期临床试验已经有第一位病人入组治疗。此项研究试验旨在确定药物的合适治疗剂量,同时初步确定药物的临床疗效和安全性,该项研究的详细信息可在clinicaltrials.gov查询,其编码是NCT03124459。
腓骨肌萎缩症(CMT)是一种常见的遗传性神经疾病,据不完全统计仅在美国就有超过12.5万患者。该病的直接临床表现是四肢肌无力,因此患者的日常生活和行动受到严重影响,目前FDA还未批准有效药物治疗该疾病。
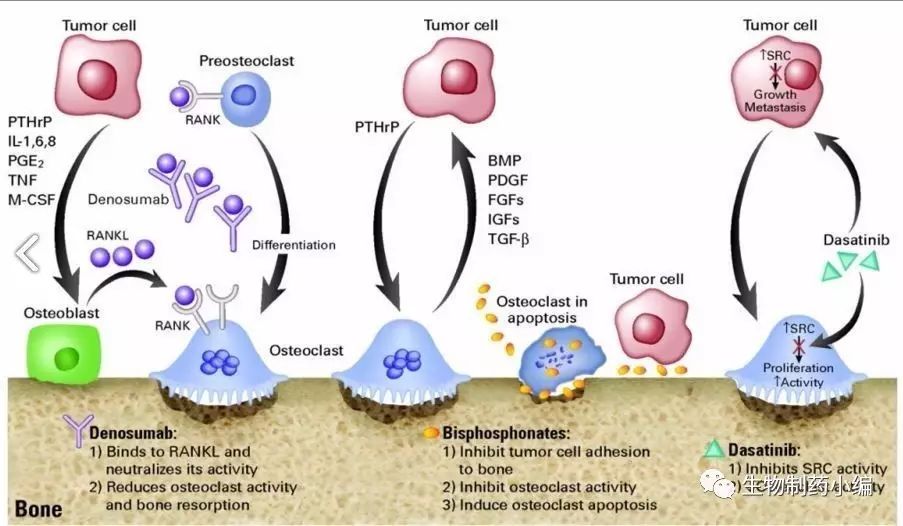
Amgen递交了关于治疗骨质疏松症的
Prolia® (Denosumab)
的新补充生物许可申请
7月31日,美国,Amgen公司今日宣布其已经向FDA递交了新的关于Prolia® (Denosumab)的补充生物许可申请。此次的补充申请是基于一项3期临床研究,旨在比较在治疗骨质疏松症方面Prolia和risedronate的有效性和安全性。该项三期临床研究显示,相较于对照组Prolia®(Denosumab)的治疗可以显著增加患者的骨密度,减少骨折风险,同时有关药物不良反应也并不会增加。
在炎症性疾病的治疗过程中,糖皮质激素的使用可以诱发骨质酥松症,已经有数据显示,糖皮质激素的使用可以使骨折的风险增加75%,且在随后的数月中,患者的骨密度会持续下降。
Prolia® (Denosumab)在之前已经被批准用于绝经后妇女的骨质酥松症的治疗,可以显著降低相关骨折的风险。如若此次适应症获批,则极大的增加Prolia® (Denosumab)的适应人群,拓宽该药的市场份额,同时也弥补了现有临床治疗的不足。
Amgen和Allergan公司向FDA递交了生物仿制药ABP980的生物许可申请
7月31日,Amgen和Allergan公司今日宣布其已经向FDA递交了Herceptin® (Trastuzumab)仿制药ABP980的生物许可申请。之前的3期临床比较研究显示ABP980与参比制剂在临床有效性、安全性和免疫原性等方面一致,揭示二者等效。
Amgen和Allergan公司基于肿瘤治疗一共合作了四个仿制药,ABP980是其中第二个申请上市的药物。ABP980是Trastuzumab的仿制药,一种重组的人源化单克隆抗体药物,可用于HER2阳性乳腺癌和胃癌的治疗。
 Herceptin Biosimilars in Development
Herceptin Biosimilars in Development
FDA已经受理了关于Celltrion和Teva的仿制药申请
7月31日,韩国和以色列,Celltrion和Teva公司今日宣布其提交的关于Herceptin® (Tastuzumab)仿制药CT-P6的生物许可申请FDA已经受理。前期的比较性试验数据显示CT-P6具有与参比制剂同样的质量、疗效及安全性,可用于用于HER2阳性乳腺癌和胃癌的治疗,且其价格相较于原研药物便宜,可以使更多的患者负担的起。目前越来越多的Herceptin®(Trastuzumab)仿制药即将上市或处在研发阶段,这一方面肯定了药物的临床疗效和市场前景,另一方面也给患者更低的价格去获取这一有效药物。
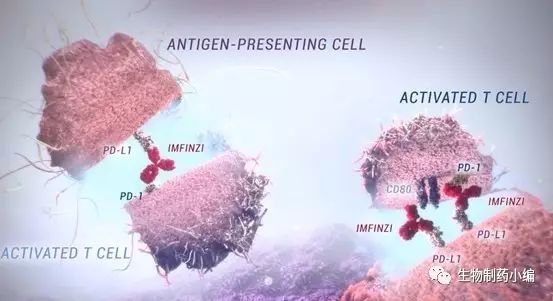
Imfinzi (Durvalumab)获得FDA突破性疗法认证
7月31日,美国,AstraZeneca 和MedImmune公司今日宣布基于非小细胞肺癌的治疗获得FDA突破性疗法的认证。因为前期的3期临床数据显示Imfinzi (Durvalumab)对于早期未发生癌细胞转移的非小细胞肺癌患者疗效显著。
为了加快新药的研发,突破性疗法是赋予那些在严重疾病领域具有实质性临床改善药物的荣誉称号,其根本目的是改善现有临床治疗未能满足的状态。
Imfinzi (Durvalumab)是一种人源化单克隆抗体,能够靶向PD-L1,从而有效干扰其与PD-1和CD80的相互作用,阻断信号转导,达到对抗肿瘤免疫逃逸的目的。目前该药同时在参与除非小细胞肺癌以外的小细胞肺癌、转移性膀胱癌、头颈癌等其它临床试验以拓宽该药的新适应症。
欢迎加入小编团队成为小编一员
请加小编微信号:wuwenjun7237
如有技术解读、行业洞见愿意分享
欢迎投稿到小编邮箱:
[email protected]




















