本文为
国君医药
丁丹团队第40篇一致性评价系列专题纪要报告

事件:
2017年11月29日,总局食品药品审核查验中心发布工作动态,表示已于11月23日启动首批仿制药一致性评价品种的有因现场检查工作。
点评:
1)
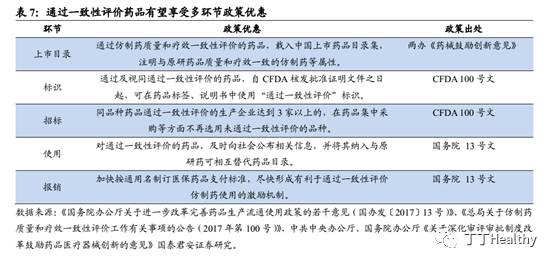
CFDA启动首批有因现场检查工作,取得一致性评价新突破。
结合CDE受理文号时间和检查的省份,我们预计首批启动现场检查的7个品种为9月29日前总局受理的改变处方工艺的一致性评价申请品种,包括德展健康的阿托伐他汀钙片等。鉴于有因检查是仿制药品种获批通过一致性评价的最后一关,此次启动首批仿制药一致性评价品种的有因现场检查工作,对于开展近2年的一致性评价工作而言,属于突破性进展。
2)
第一批仿制药品种有望2017年底或2018年初通过一致性评价。
政策要求有因检查在立卷审查结束后60个工作日内完成,在100号文出台前,省局现场核查(包括浙江省局对京新药业瑞舒伐他汀钙、广东省中山分局对联邦制药中山公司阿莫西林胶囊等)多在4个工作日左右:我们预计有因检查实际需要时间大概在3-5天,完成之后抽样复核检验,形成意见反馈到CDE做后续的审核。如果后续不需要补充资料,我们预计第一批品种最快可能于2017年底或2018年初正式获批通过。
3)
一致性评价主题之风渐起,长周期起点,优选优势企业。
截止2017年12月4日,有44个国内已上市仿制药的一致性评价、15个出口转内销、9个撤回重报申请,三大路径共计68个申请,第一批品种获批临近。我们认为随着一致性评价的推进,将加速中国制药工业去产能化,优化市场竞争格局,“剩”者为王,供给侧改革的春天将到来,拥有优秀治疗型品种的制药企业最终会受益于行业变局的结构性机会,制药行业进入长周期新起点。随着第一批品种有望在2017年底或2018年初获批,仿制药一致性评价主题之风渐起。核心推荐标的:华海药业、恒瑞医药、乐普医疗、泰格医药、上海医药。受益标的:京新药业、普利制药、德展健康。
风险提示:
一致性评价推进进度低于预期;政策进度低于预期
1. 一致性评价新突破:启动首批有因现场检查工作
2017年11月29日,总局(CFDA)食品药品审核查验中心(CFDI)发布工作动态,表示已于11月23日启动首批仿制药一致性评价品种的有因现场检查工作。首批启动现场检查的7个品种是在总局药品审评中心(CDE)完成立卷审查的基础上开展的。本次检查核查中心共派出6个检查组,分别奔赴北京、重庆、浙江、江苏、湖南、江西等省、直辖市。
根据总局2017年5月18日关于发布仿制药质量和疗效一致性评价研制现场核查指导原则等4个指导原则的通告(2017年第77号)中《仿制药质量和疗效一致性评价有因检查指导原则》的规定:
“有因检查是针对一致性评价工作中发现的问题、质疑、举报等情形开展的针对性检查”。而且,“必要时,现场抽取样品送一致性评价办公室指定的药品检验机构进行复核检验。”
此外,总局2017年8月25日发布的关于仿制药质量和疗效一致性评价工作有关事项的公告(2017年第100号)中也明确说明:
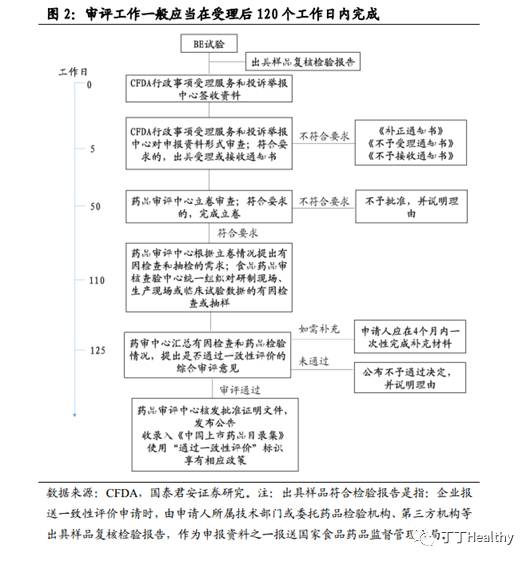
“国家食品药品监督管理总局药品审评中心根据立卷审查情况提出有因检查和抽检的需求,由国家食品药品监督管理总局食品药品审核查验中心统一组织进行对研制现场、生产现场或临床试验数据的有因检查或抽样。需要检验的,指定有关检验机构。有因检查工作一般在立卷审查结束后60日内完成”。
因此我们认为,首批启动有因现场检查工作的品种,可能需要经过1)
研制现场、生产现场或临床试验数据的有因检查以及
2)
必要时的复核检验
。总体来看,总局对于仿制药企业一致性评价申请资料的审评工作主要分为三个阶段:
形式审查、立卷审查和有因检查或抽样
。而且,审评工作一般应当在受理后120日内完成。有因检查完成后,总局药审中心汇总有因检查和样品检验的情况,提出是否通过一致性评价的综合审评意见。
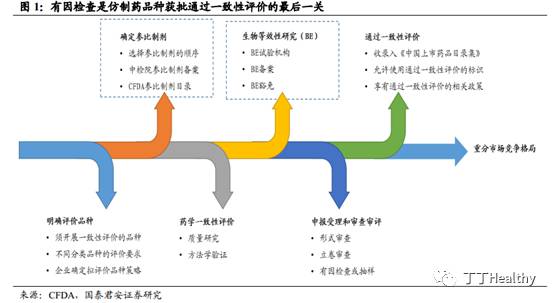
整体看,我们认为有因检查是总局对于在一致性评价审查过程中发现的问题或疑惑开展的进一步核查,以解惑释疑的过程。根据审评流程,
有因检查可以认为是仿制药品种获批通过一致性评价的最后一关
。此次启动仿制药一致性评价品种的有因现场检查工作,对于开展近2年的一致性评价工作而言,属于突破性进展。
2. 预计阿伐托他汀片等属于第一批检查品种
首批申报一致性评价品种大概率均需接受有因现场检查以及复核检验。
根据政策要求,有“因”才需检查,并非所有品种都需进行有因现场检查以及必要时的复核检验。但是考虑到此为总局首次开展一致性评价审查工作,急需积极探索经验建立“以品种为核心基于审评风险控制的检查模式”,规范后续一致性评价品种的审评审批工作;同时,首批通过品种对于整个一致性评价工作的重要性,要求总局必须谨慎严肃对待。因此,我们认为,首批申报一致性评价品种,尤其是改变处方工艺的品种,大概率都会要求接受有因现场检查以及复核检验。
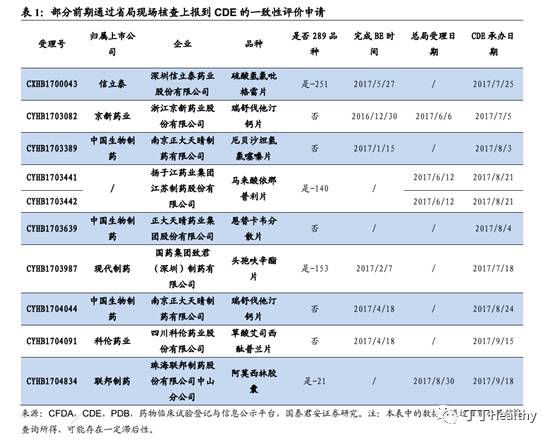
前期通过省局现场核查上报CDE品种大概率不在此次现场检查之列。
由于此前备受市场关注的京新药业瑞舒伐他汀钙、信立泰氯吡格雷等品种,均在100号文发布之前就已通过省局现场核查上报CDE。我们预计此类品种,总局可能利用省局现场核查资料进行审查,而不会再重复现场核查工作。因此,这些品种大概率并不在总局首批现场核查之列。
截止12月4日,总局已统一受理34个仿制药一致性评价申请,
分布在四川、浙江、广东、河北、吉林、江苏、湖南、重庆、北京、江西、上海、山东等12个省市。此次派出检查组的6个省市涉及的一致性评价申请:
北京:仅德展健康阿托伐他汀钙片
重庆:仅复星医药阿法骨化醇片
浙江:2家企业4个品种
江苏:5家企业6个品种
湖南:1家企业2个品种
江西:1家企业2个品种
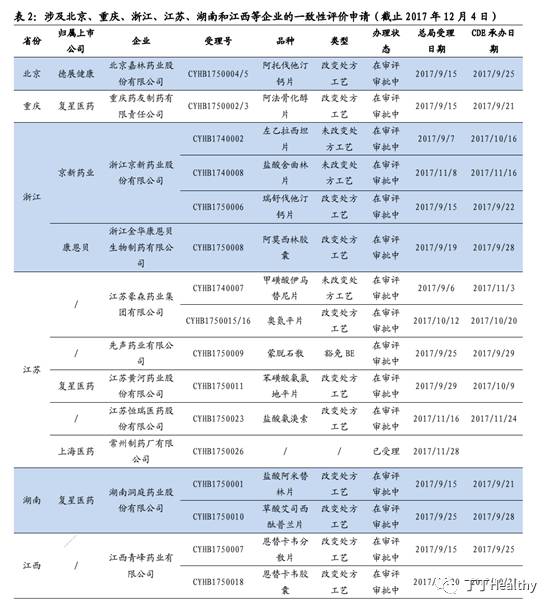
结合受理文号时间和检查的省份,我们预计
首批启动现场检查的7个品种均为9月29日前总局受理的改变处方工艺的一致性评价申请品种,包括德展健康阿托伐他汀钙片等
。鉴于100号文要求立卷审查应在受理后45个工作日内完成,10月份之前受理的这些品种此时完成立卷审查开展有因检查,时间吻合。
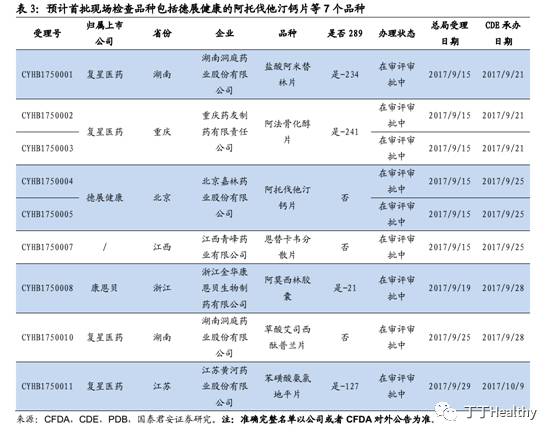
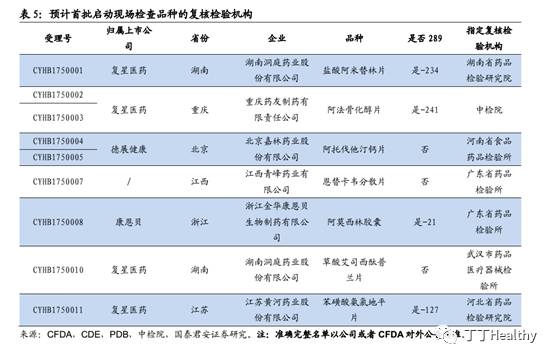
根据流程完成有因现场检查,预计后续到相应的复核检验机构完成抽样检验。根据CFDA和中检院目前为止发布的三项一致性评价品种复核检验机构政策的内容,我们预计这7个品种将在6个指定复核检验机构进行。
3. 第一批仿制药品种有望2017年底或2018年初通过审批
政策要求有因检查在立卷审查结束后60个工作日内完成。根据100号文出台前,省局现场核查多在4个工作日左右:
1)浙江省局对京新药业瑞舒伐他汀钙的研制、生产、生物等效实验情况现场检查工作从6月6日-9日;
2)广东省中山分局对联邦制药中山公司阿莫西林胶囊研制现场核查和生产现场检查从8月15日-17日。
因此,我们预计有因检查实际需要时间大概在3-5天,完成之后经过抽样复核检验,形成意见反馈到CDE做后续的审核。如果后续不需要补充资料,我们预计第一批品种最快可能于2017年底或2018年初正式获批通过。
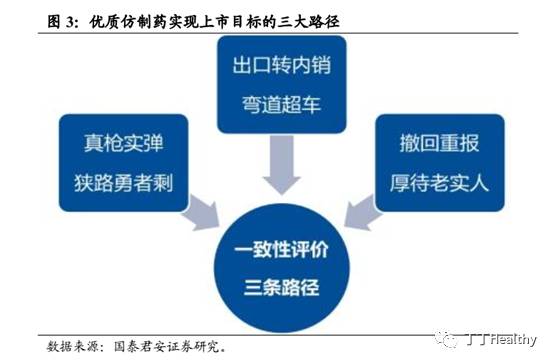
4. 仿制药实现上市三大路径已有68个申请被受理
一致性评价开展至今,优质仿制药实现上市的三大路径逐渐清晰:
1)大多数的存量品种,真枪实弹,狭路勇者剩:
中国目前大多数已上市的仿制药与原研药品在质量和疗效上存在不一致现象,需要弥补“历史旧账”。制药企业须积极进行品种梳理,开展药学研究,抢占国内BE试验资源,又快又好地完成仿制药一致性评价,抢占市场空间;
2)工业基础良好、国际化能力较强的企业的品种,出口转内销,弯道超车:
在欧盟、美国、日本等发达市场上市的品种转向国内申报时,在优先审评及国外上市转国内申报审核后视同通过一致性评价的政策鼓励下,有望加快国内上市,实现弯道超车;
3)主动撤回重新申报企业品种,厚待老实人:
撤回后按与原研药一致性标准进行研究,重新申报将获得优先审评的政策倾斜,有望加快上市。
截止2017年12月4日,通过跟踪总局CFDA和CDE的数据,我们发现这三条一致性评价路径上,均已有部分品种进入审评审批阶段。其中有约44个国内已上市仿制药存量品种的一致性评价申请,15个出口转内销申请和9个撤回重报品种申请,共计68个申请(具体品种名单见附件),有望成为第一批通过评价的品种,在标识、招标、医保报销等多环节享受政策优惠。