昨天咱们探讨了重庆医科大学发表的一篇影响因子高达16.7 分的文章,今天就让我们深入剖析一下,这篇文章究竟是以怎样的思路孕育而生的(
所有的科研文献,追根溯源,本质上都是 “假设→验证→假设迭代” 这一过程的产物,不清楚的可以去看下《科研的推理和逻辑:从实验台到咖啡桌》、《列文虎克读文献》和《信号通路是什么鬼?》系列
):

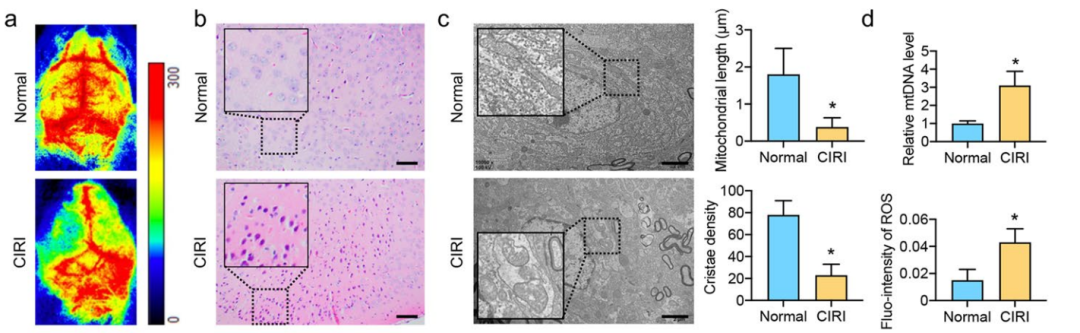
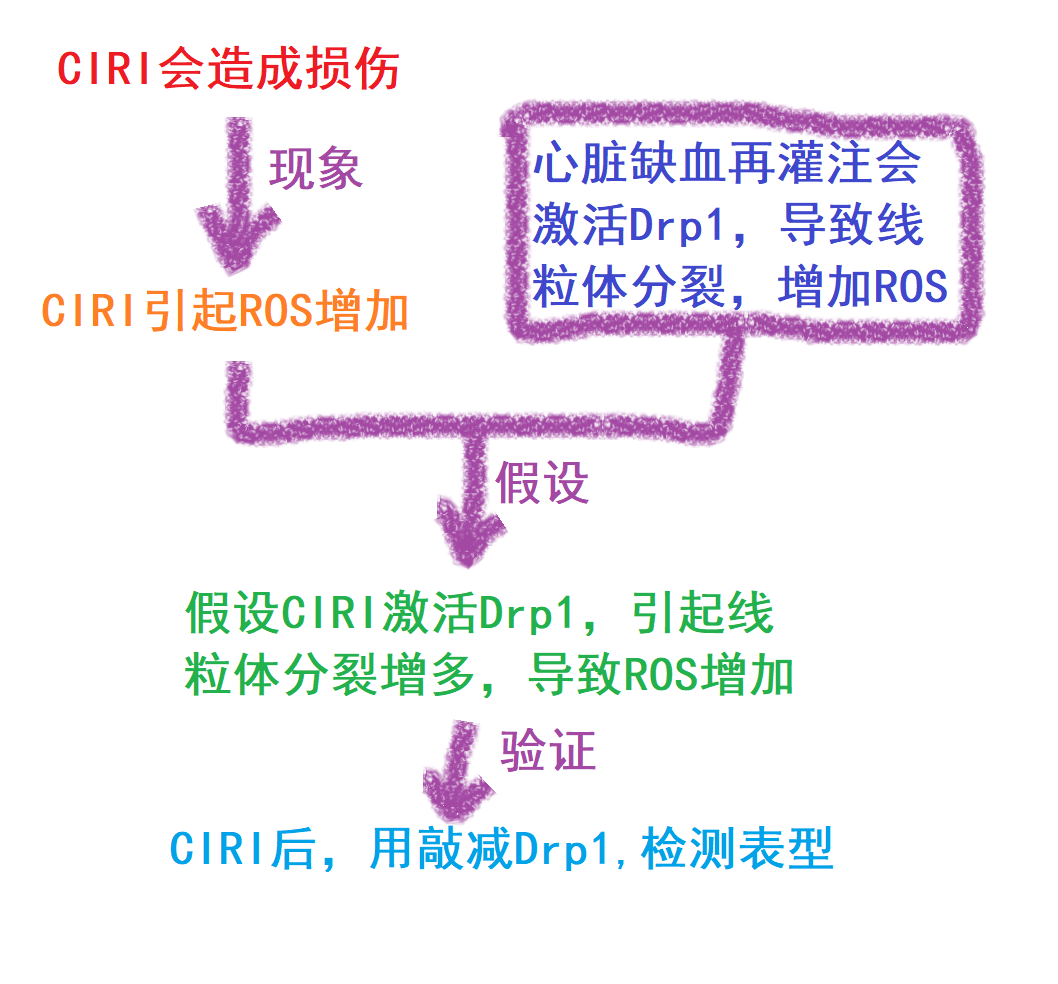
这篇文章最初聚焦于脑部缺血再灌注损伤(CIRI)对细胞产生的影响。研究团队借助体外模型发现,CIRI 发生后,细胞内会出现活性氧(ROS)累积等一系列现象(
这就是通过归纳法将ROS的产生与CIRI联系了起来,两者的联系,就是接下去他们进一步提出假设的起点,归纳法也就是通过归纳总结,为假设提出奠定基础的关键,不清楚归纳法的话,可以去看看《列文虎克读文献》和《科研的推理和逻辑:从实验台到咖啡桌》
)。
与此同时,另一篇文献指出,在心脏缺血再灌注损伤中,动力相关蛋白 1(Drp1)的激活引发线粒体过度分裂,是导致 ROS 累积的关键因素。
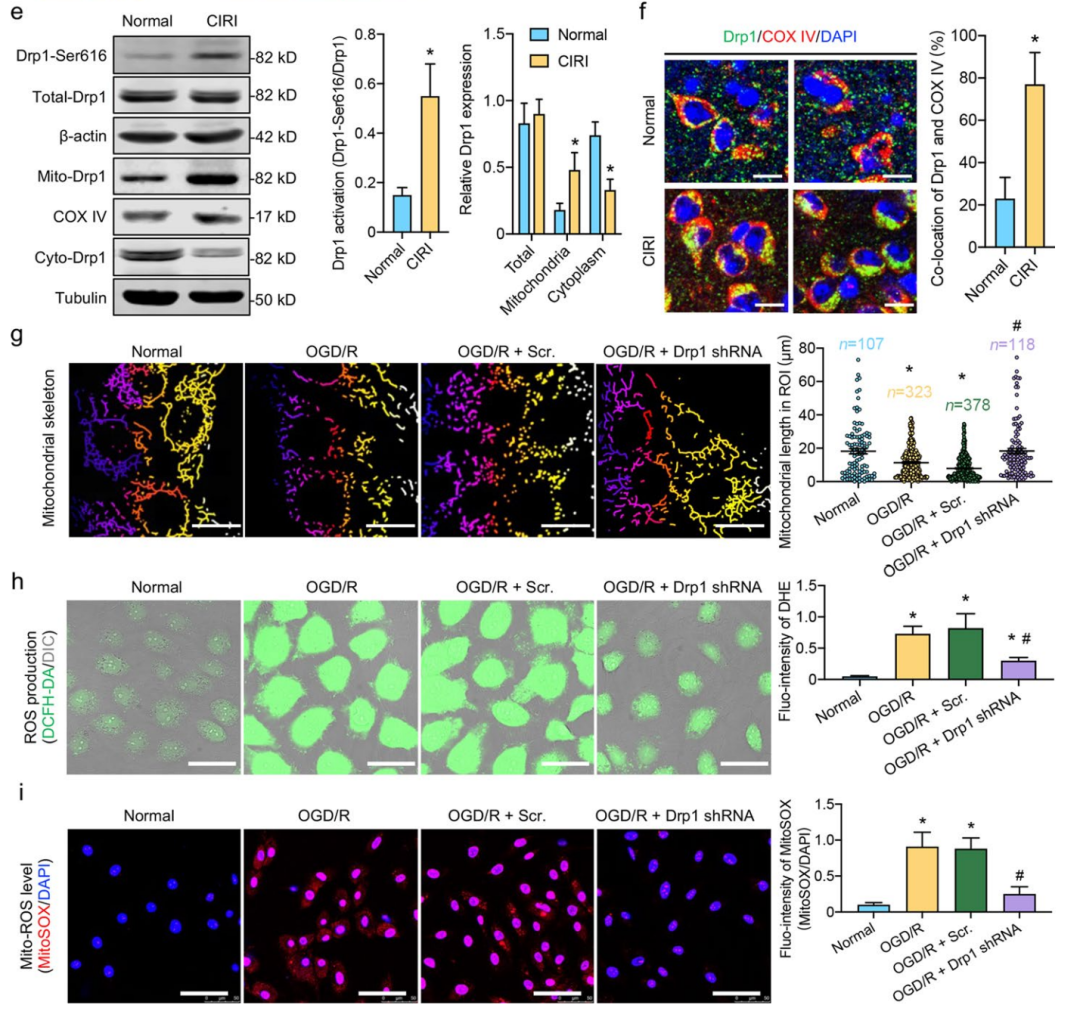
基于此,该研究团队对 CIRI 发生后 Drp1 的激活情况以及线粒体的变化展开分析。同时,他们验证了敲减 Drp1 对 CIRI 后 ROS 水平恢复的作用(
实际上,这就是简单的柯霍氏法则验证,通过去除可能的影响分子Drp1,来查看下游可能影响的ROS水平的表型,不清楚柯霍氏法则的话,可以看下《科研的推理和逻辑:从实验台到咖啡桌》和《轻松的文献导读》
)。
其实,上述步骤是通过借鉴同类文献的研究成果,提出了一个相似的假设并加以验证(
假设的提出和假设的迭代,就是基于已有研究,或者基于前一个假设的实验验证结果,总结之后提出的,假设的提出和假设的迭代,对于一篇文章或者一个课题的推进而言,是必不可少的,不清楚假设或者假设迭代的话,可以去看看《科研的推理和逻辑:从实验台到咖啡桌》
)。原本的研究是针对心肌缺血再灌注损伤,而他们巧妙地将该研究机制迁移至脑部缺血再灌注损伤的研究中。
既然发现 Drp1 在 CIRI 后被激活,那么就不得不考虑 Drp1 自身的功能。另一篇文献表明,Drp1 的功能是激活线粒体分裂,进而引发线粒体自噬。
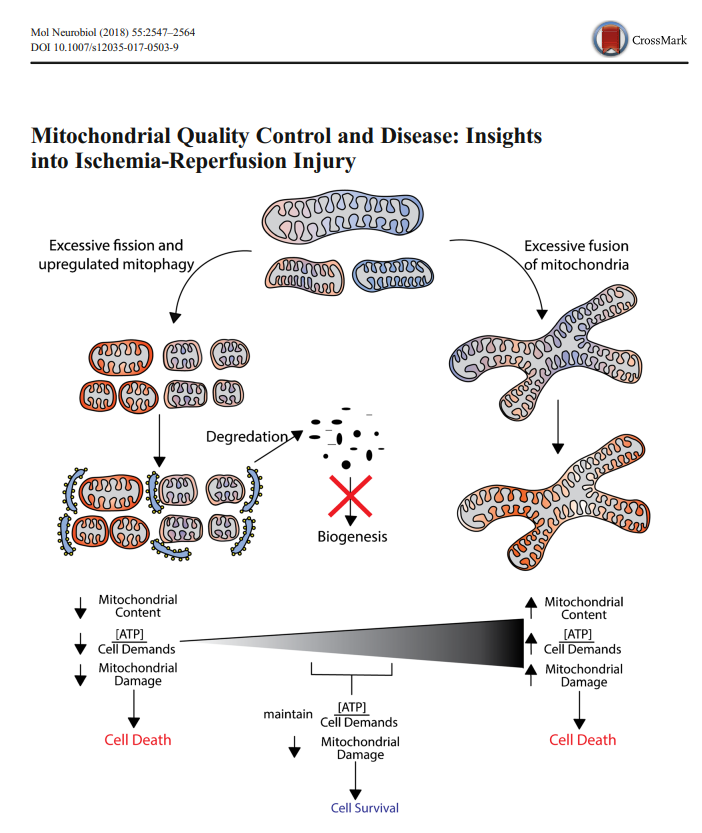
确实,在 CIRI 发生后,线粒体与 P62 的共定位情况发生了改变(
倘若你还记得线粒体自噬的相关知识,就会明白 P62 与线粒体共定位的意义,当线粒体产生损伤后,p62就会结合线粒体,并将损伤的线粒体包裹进入自噬体,从而引发线粒体自噬,相关内容在《信号通路是什么鬼?》系列自噬和线粒体自噬相关的章节中有详细讲解
)。
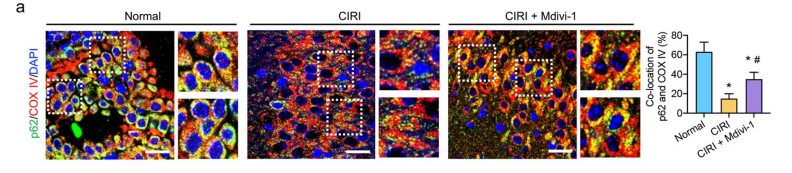
P62 通过与 LC - 3 结合形成自噬体,将受损的线粒体包裹起来,启动线粒体自噬过程。
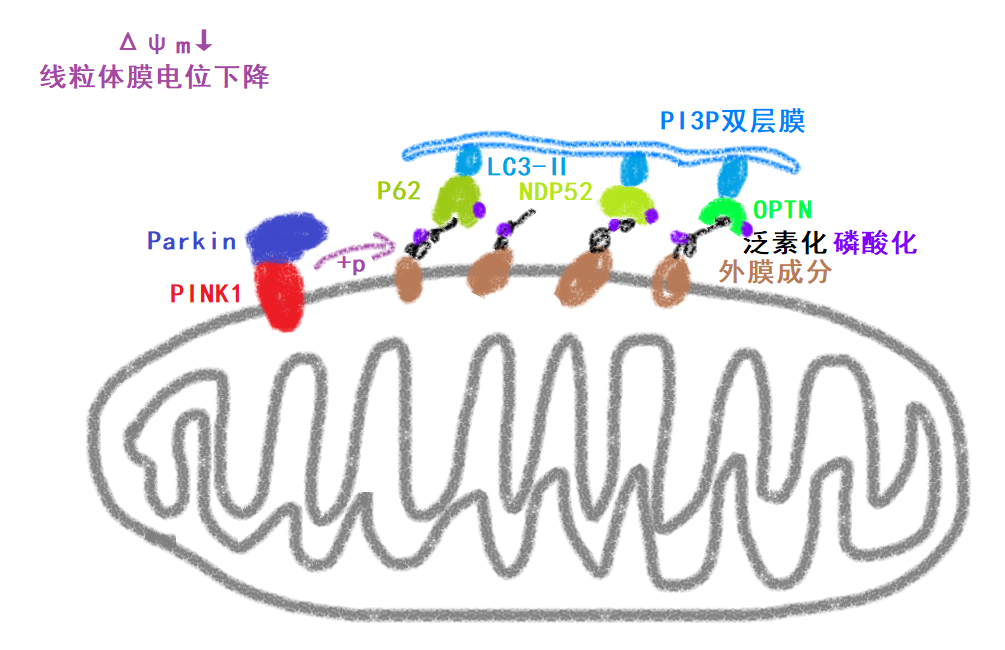
而这一过程可被 Drp1 的敲减所逆转,这意味着 Drp1 的激活促使分裂后的线粒体进入自噬体(
也就是被含有LC3的自噬体膜包裹后形成的自噬体,当自噬体包裹了损伤的线粒体后,再通过结合溶酶体,则能导致损伤线粒体的降解,从而清除损伤线粒体,不清楚这一过程的话,可以去看看《信号通路是什么鬼?》系列的自噬那几章复习下
)。
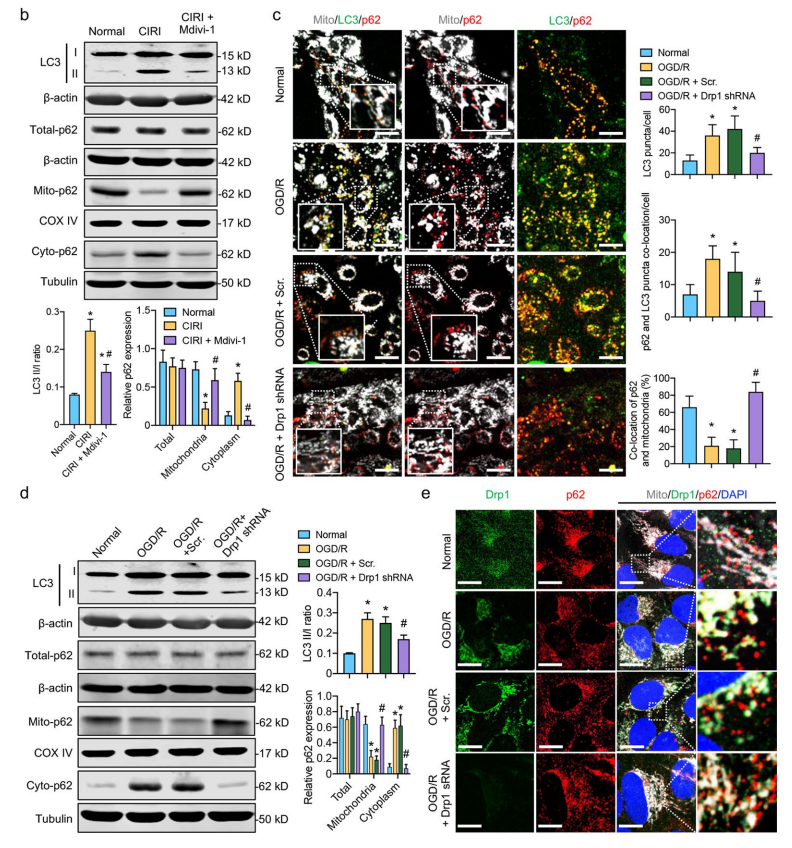
随着实验结果的逐步呈现,文章的研究方向也经历了进一步的假设迭代。研究重点从最初的 Drp1 激活引发 ROS 累积,转向了 Drp1 激活后引发线粒体自噬这一方向。
此处的假设迭代依旧是受其他类似研究文献的启发,但后续的研究则有所不同。研究团队开展了简单的自噬相关实验,即采用 mRFP - GFP - LC3(
如果你看过《夏老师带你读文献》,应该记得在讲解自噬实验图时提及过此类实验,这个实验的主要验证原理就是,当自噬体与溶酶体结合时,会发出红色荧光。通常会使用 mCherry,而在此实验中使用的是 mRFP,同样发出红光
)。
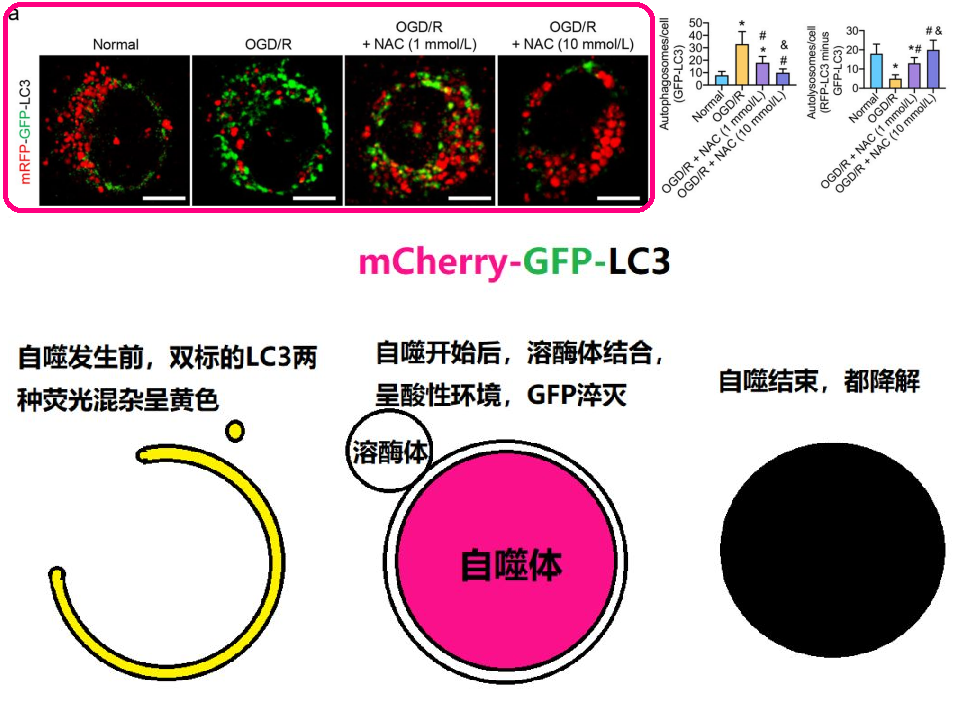
这个实验成为了文章假设迭代的另一个关键转折点。通过该实验,研究团队发现 Drp1 虽然激活了线粒体自噬,但并未促进自噬体与溶酶体的结合。也就是说,自噬体未能被降解,线粒体自噬过程被阻滞。
一般而言,多数文献进行到这一步,往往会将线粒体自噬阻滞作为一种研究机制而告终。然而,这篇影响因子16.7分的文章却以此现象为契机,进行了更进一步的假设迭代(
这里他们把原有的假设,进一步迭代成了“为何会出现溶酶体与自噬体无法结合的情况?”,可以看得出来,这篇文章的研究方向已经通过不断地假设迭代发生了质的改变,这就是假设迭代造成的,不清楚假设迭代的话,可以去看看《科研的推理和逻辑:从实验台到咖啡桌》和《信号通路是什么鬼?》系列
)有文献表明,受体相互作用蛋白 1(RIP1)和受体相互作用蛋白 3(RIP3)可能参与了溶酶体与自噬体的结合过程。

于是,研究团队的假设迭代为:Drp1 可能通过激活 RIP1/RIP3
(
RIP1/RIP3大家应该也比较熟悉了,这俩蛋白和坏死性凋亡信号通路也密切相关,不清楚的话,可以去看看《信号通路是什么鬼?》系列中的坏死性凋亡那几章,复习下
)
,抑制了溶酶体与自噬体的结合过程。随后,他们展开了验证工作。为了对比 Drp1 激活与未激活两种状态,他们采用了对 Drp1 氨基酸进行突变的方法。将磷酸化位点突变为丙氨酸后,Drp1 将丧失磷酸化能力。通过这一方法,他们验证了 Drp1 能够激活 RIP1/RIP3,并促进 RIP1 与 RIP3 的结合。

这一步的验证是基于实验结果提出的假设迭代。实验发现 Drp1 影响线粒体自噬的关键在于阻碍自噬体与溶酶体的结合,而造成这一现象的原因很可能与 RIP1/RIP3 有关。研究团队依据这些线索,提出新的假设并进行验证。

到这一步,研究看似已较为完整,但研究团队并未止步,而是再次进行了假设迭代,这一步的思路十分巧妙。既然自噬体与溶酶体的结合受到抑制,那么这些被阻滞的自噬体膜结构会有怎样的归宿呢?研究团队首先联想到外泌体的形成,于是进一步迭代了假设。这一步的假设迭代同样建立在实验结果的基础之上。

通过验证,他们发现 CIRI 激活 Drp1 后导致的自噬阻滞所形成的自噬体,确实会转化为外泌体排出细胞,他们利用标记的 P62 证实了这一结果。

那么,累积的自噬体形成外泌体后,这些多余的外泌体是否会产生其他影响呢?研究团队再次进行假设迭代,分析了外泌体的组成成分,并收集这些外泌体,研究其对细胞的影响。

研究发现,Drp1 激活形成的线粒体自噬体累积所产生的外泌体,会激发炎症相关因子的表达,进而进一步促进 RIP1/RIP3 的激活(
这一过程可参考坏死性凋亡信号通路,相关内容在《信号通路是什么鬼?》系列中有详细讲解
),形成了一个正反馈循环。

尽管这篇文章的影响因子为 16.7 分,但它的研究思路以及假设迭代过程十分流畅。通过参考已有文献和实验结果,不断迭代原有假设,推动研究进展,这才是科研应有的模样。
喜欢夏老师讲文献
的话,
可以点点星标,点点赞,点点“在看
”,多分享多转发。
公众号回复“公克”,没事可以翻翻精华帖,里面有不少宝藏工具,
当作是科研过程中的一种调剂也是不错的选择哦
,
科研并不一定要这么无聊又尴尬
:
目前夏老师已正式出版11本书,想要的可直接点以下微店小程序直接购买:














